1. Introduction
La nutrition peut affecter négativement ou positivement la qualité du sperme et cet effet dépend à la fois des aspects quantitatifs et qualitatifs d’un régime alimentaire, tels que la teneur en calories de chaque macronutriment (glucides, protéines et lipides), ainsi que des profils spécifiques d’acides gras, de glucides et de protéines.
De plus, un apport adéquat en antioxydants s’est avéré très efficace dans la prévention et/ou le traitement de l’infertilité masculine.
2. Régimes alimentaires et fertilité masculine
2.1. L’alimentation occidentale comme facteur de risque d’infertilité masculine
Ces dernières décennies, le régime alimentaire dominant est devenu le régime dit « occidental », conséquence de l’occidentalisation du mode de vie. Ce régime se caractérise par une forte consommation d’aliments transformés industriellement, riches en protéines animales, en glucides simples, en acides gras trans et saturés, et pauvres en fibres alimentaires et en acides gras essentiels insaturés. Des études récentes ont établi un lien entre ce régime et un risque accru de maladies métaboliques, d’athérosclérose, de maladies neurodégénératives, de cancers et d’infertilité.
Le régime alimentaire occidental a donc largement contribué à l’augmentation du taux d’obésité, ce qui a un impact significatif sur la fertilité par le biais de modifications des taux hormonaux, de la fonction spermatique et de la composition moléculaire des gamètes.
Contrairement au régime occidental, le régime méditerranéen, considéré comme l’un des plus sains, présente des bienfaits avérés pour la santé, notamment sur la qualité du sperme. Ce régime se caractérise par une forte consommation de légumineuses, de céréales, de fruits et de légumes, une consommation modérée de poisson et de vin, et une faible consommation de produits laitiers et de viande ; l’huile d’olive en est la principale source de matières grasses ajoutées. Ainsi, le régime méditerranéen est riche en acides gras mono-insaturés (AGMI), en fibres et en antioxydants, et pauvre en acides gras saturés (AGS).
Un autre modèle alimentaire, le régime végétarien, présente une composition similaire à celle du régime méditerranéen, mais exclut la viande et les produits carnés, la volaille, les fruits de mer et la chair de tout autre animal. Récemment, l’impact de ce régime sur la fertilité masculine a suscité un intérêt considérable, car il a été suggéré qu’il pouvait diminuer la qualité du sperme.
L’augmentation du tissu adipeux induit une résistance à l’insuline et joue un rôle important dans le développement du stress oxydatif, altérant ainsi les voies de reproduction et la fonction spermatique.
L’obésité perturbe divers composants de l’axe hypothalamo-hypophyso-gonadique, provoquant un hypogonadisme [ 27 ], qui est principalement associé à des niveaux réduits de testostérone et à un nombre réduit de spermatozoïdes
L’hyperinsulinémie et l’hyperglycémie, caractéristiques de la résistance à l’insuline, semblent responsables de la réduction de l’absorption et du métabolisme du glucose par les spermatozoïdes contribuant ainsi potentiellement à l’altération de la glycolyse dans ces cellules. Il est important de souligner que la glycolyse, associée à la phosphorylation oxydative (OXPHOS), est une voie métabolique produisant de l’adénosine triphosphate (ATP), principale source d’énergie des spermatozoïdes.
L’absorption et l’homéostasie du glucose peuvent également être modulées par la leptine libérée par les adipocytes dans les tissus adipeux. Ce qui peut avoir un impact négatif sur la fonction reproductive masculine et la qualité du sperme.
La leptine joue également un rôle important dans l’état pro-inflammatoire chronique du microenvironnement testiculaire et/ou du système canalaire excréteur, augmentant ainsi le niveau d’espèces réactives de l’oxygène (ROS) qui sont responsables de la diminution de la qualité du sperme.
L’excès de tissu adipeux entraîne une augmentation de l’activité de l’aromatase, enzyme responsable de la conversion de la testostérone en œstradiol. La diminution consécutive du taux de testostérone induit une faible production de spermatozoïdes, car cette hormone est le principal androgène testiculaire impliqué dans la régulation de la spermatogenèse. Un faible taux de testostérone semble être lié non seulement au stress oxydatif, mais aussi à un dysfonctionnement mitochondrial des cellules de Leydig, situées dans le tissu conjonctif entourant les tubes séminifères, où se déroule la première étape de la synthèse de la testostérone.
Les anomalies des mitochondries des cellules de Leydig sont responsables de dommages oxydatifs aux lipides, aux protéines et à l’ADN mitochondrial (ADNmt), entraînant une diminution des niveaux d’ATP et une augmentation de la production d’espèces réactives de l’oxygène (ROS). Les cellules germinales et les spermatozoïdes matures sont sensibles au stress oxydatif, ce qui conduit à une diminution de la qualité du sperme (diminution du nombre et de la mobilité des spermatozoïdes et augmentation des anomalies morphologiques.
2.2. Le régime méditerranéen comme facteur de protection contre l’infertilité masculine
L’un des facteurs expliquant les bienfaits du régime méditerranéen sur la fertilité masculine est sa faible teneur en acides gras saturés et trans ainsi que ses apports adéquats en nutriments essentiels tels que les oméga-3, les antioxydants et les vitamines.
Il a d’ailleurs été démontré que la consommation de vitamines antioxydantes et de caroténoïdes était associée à une numération spermatique plus élevée. Par ailleurs, une consommation accrue de fruits, de céréales et de légumes était corrélée positivement à la mobilité et à la concentration des spermatozoïdes.
De nombreux composés naturels alimentaires isolés de fruits, de légumes et de plantes comestibles peuvent cibler les mitochondries, modulant leur métabolisme, leur biogenèse et leur statut redox.
La protection de la fonction mitochondriale par ces composés pourrait expliquer leurs effets bénéfiques sur la fonction reproductive masculine.
Une autre caractéristique du régime méditerranéen est la consommation d’huile d’olive comme principale source de lipides. Il a été démontré, chez l’animal, qu’une supplémentation en huile d’olive améliorait significativement la qualité du sperme. Ceci s’explique par le fait que l’huile d’olive, principale source d’acides gras mono-insaturés (AGMI), pourrait modifier la composition lipidique de la membrane des spermatozoïdes, réduisant ainsi les dommages liés au stress oxydatif et restaurant la fonction mitochondriale.
L’huile d’olive est également une source naturelle de vitamine E et de polyfénol ayant des propriétés antioxydantes.
De plus, le régime méditerranéen induit une réduction des acides gras oméga-6 au profit des acides gras oméga-3, qui ont été associés à une amélioration du métabolisme énergétique des spermatozoïdes
3. Impact des nutriments sur les aspects moléculaires liés à la qualité du sperme
3.1. Matières grasses alimentaires
Les lipides alimentaires peuvent influencer la composition lipidique des spermatozoïdes, avec des conséquences néfastes ou bénéfiques sur le potentiel reproducteur masculin.
3.1.1. Acides gras
Dans les spermatozoïdes, les acides gras sont des constituants de la membrane gamétique ainsi que des fournisseurs d’énergie et peuvent provenir d’une synthèse de novo ou de sources alimentaires.
Les régimes riches en acides gras saturés et pauvres en acides gras polyinsaturés ou avec un rapport oméga-6/oméga-3 déséquilibré ont affecté négativement la qualité du sperme, tandis que la supplémentation en acides gras insaturés alimentaires a amélioré la qualité du sperme.
Chez l’homme, l’apport alimentaire en graisses saturées est inversement corrélé au nombre total et à la concentration de spermatozoïdes.
A l’inverse, l’apport en acides gras oméga-3 est positivement corrélé à la qualité du sperme.
Cependant, l’amélioration de la qualité du sperme grâce aux acides gras oméga-3 ne s’accompagne pas toujours de modifications du profil d’acides gras des spermatozoïdes. Par conséquent, un rôle des acides gras dans la régulation du métabolisme des spermatozoïdes a été proposé.
Les AGPI peuvent influencer les processus de reproduction, directement ou indirectement, par plusieurs mécanismes :
- par exemple, les AGPI peuvent favoriser la perte de masse grasse, prévenant ainsi l’obésité et, par conséquent, l’apparition de l’infertilité. I
- ils agissent également sur des aspects spécifiques liés à la fertilité masculine. En effet, ces acides gras sont aussi des constituants de la membrane spermatique, dont la fluidité et la dynamique sont essentielles à la fécondation. Ils sont également des précurseurs de la synthèse des eicosanoïdes, qui peuvent moduler de nombreuses enzymes clés impliquées dans le métabolisme des stéroïdes.
- les mécanismes moléculaires responsables des effets des AGPI sur la fertilité masculine pourraient être liés à une modulation parallèle du métabolisme lipidique et de la fonction mitochondriale des spermatozoïdes.
Le DHA et l’EPA sont des acides gras polyinsaturés à longue chaîne oméga-3, présents en grande quantité dans les poissons de mer et certains végétaux verts, graines, herbes aromatiques, noix et huiles
3.1.2. Cholestérol alimentaire
Il a été démontré que l’hypercholestérolémie modifie la composition et la dynamique de la membrane plasmique, altérant ainsi la morphologie et la fonction des spermatozoïdes.
L’impact du cholestérol alimentaire sur la fertilité masculine reste mal compris au niveau moléculaire. On sait toutefois que le cholestérol est un lipide essentiel à la structure et à la dynamique des membranes spermatiques, ainsi qu’à la synthèse de la testostérone. En effet, les taux de cholestérol dans la membrane des spermatozoïdes influencent la fluidité membranaire, laquelle joue un rôle clé dans la motilité, la capacitation et la réaction acrosomique des spermatozoïdes.
Parallèlement, le cholestérol alimentaire pourrait induire une accumulation de cholestérol dans les cellules de Leydig testiculaires. Bien que le cholestérol soit le substrat de la biosynthèse de la testostérone, un excès peut s’avérer dangereux, car des taux élevés de cholestérol activent le stress du réticulum endoplasmique, entraînant une diminution de l’expression des enzymes stéroïdogènes et, par conséquent, une baisse de la production de testostérone. Comme indiqué précédemment, de faibles taux de testostérone sont étroitement liés au stress oxydatif et à un dysfonctionnement mitochondrial.
3.2. Glucides alimentaires
Un lien entre la consommation de sucre et la diminution de la mobilité des spermatozoïdes pourrait être lié à l’augmentation de la résistance à l’insuline, qui correspond à une utilisation réduite du glucose par les spermatozoïdes [ 31 ]. Dans les spermatozoïdes, le glucose est le principal substrat de la glycolyse, où il est métabolisé en pyruvate et/ou lactate pour produire de l’énergie cellulaire sous forme d’ATP. Ainsi, une réduction de l’absorption et du métabolisme du glucose par les spermatozoïdes pourrait correspondre à une diminution de la concentration d’ATP, nécessaire au maintien de leur mobilité.
L’augmentation de la glycémie s’accompagne également d’une diminution du taux de testostérone et d’une augmentation du stress oxydatif. Les mitochondries des spermatozoïdes sont une cible commune du stress oxydatif et de la testostérone, ce qui réduit leur fonctionnalité. La diminution de l’efficacité respiratoire mitochondriale pourrait être responsable de la baisse de la mobilité des spermatozoïdes.
Les édulcorants de plus en plus utilisé comme alternative au sucre pourraient ne pas être plus sûrs pour la fertilité masculine que le sucre.
Une étude récente menée chez la souris a montré que de fortes doses d’aspartame étaient corrélées à une fragmentation de l’ADN et à des anomalies morphologiques des spermatozoïdes. Ces effets étaient dus à une production accrue d’espèces réactives, à un affaiblissement du système de défense antioxydant et à l’induction consécutive d’un stress oxydatif.
La stévia, édulcorant naturel originaire d’Amérique du Sud, a également été associée à une diminution du nombre de spermatozoïdes et à une baisse du taux de testostérone.
Par contre, il a été rapporté que le sucralose, l’édulcorant le plus courant, n’altère pas la qualité du sperme et n’a aucun effet sur la glycolyse spermatique.
4. Impacts des antioxydants sur les aspects moléculaires liés à la qualité du sperme
Il a été démontré que de nombreux polyphénols naturels alimentaires (principalement des flavonoïdes) isolés de fruits, de légumes et de plantes comestibles modulent le métabolisme et la biogenèse mitochondriaux, ainsi que l’homéostasie des espèces réactives de l’oxygène.
La modulation de la fonction mitochondriale par ces molécules bioactives végétales pourrait jouer un rôle important dans l’amélioration des performances reproductives masculines.
4.1 La quercétine
La quercetine est un bioflavonoïde d’origine alimentaire, largement présent dans les plantes et les légumes, qui a suscité un intérêt considérable dans le domaine de l’étude de la fertilité masculine en raison de ses puissantes propriétés antioxydantes.
Cependant, la littérature scientifique fait état de résultats contradictoires soulignant à la fois les propriétés antioxydantes et pro-oxydantes de ce flavonoïde, ce qui a conduit au « paradoxe de la quercétine dans les troubles de la reproduction masculine.
4.2 Le resveratrol
Le resvératrol est l’un des composés polyphénoliques naturels les plus étudiés. On le trouve dans plus de 70 espèces de plantes et dans le vin rouge. Certaines études ont montré qu’il améliore la qualité du sperme chez l’homme, en agissant comme régulateur de la fonction reproductive masculine.
4.3 Le licopène
Le lycopène est un caroténoïde lipophile rougeâtre fréquemment présent dans les tomates et plusieurs fruits rouges, reconnu pour ses propriétés antioxydantes et sa capacité à piéger les radicaux libres.
Il a été démontré que le lycopène a des effets positifs sur la fonction mitochondriale testiculaire.
4.4 L’astaxanthine
L’astaxanthine est un caroténoïde présent chez divers micro-organismes et organismes marins, doté de puissantes propriétés antioxydantes : elle est 100 à 500 fois plus efficace que la vitamine E pour prévenir la peroxydation lipidique.
Un effet positif de l’astaxanthine sur les paramètres spermatiques et la fertilité a été suggéré, dont le mécanisme moléculaire pourrait s’expliquer par l’amélioration de la fonction mitochondriale.
4.5 La vitamine E
La vitamine E n’est pas synthétisée par les mammifères et comprend un groupe de composés liposolubles – les tocophérols et les tocotriénols – dont l’alpha-tocophérol est la forme la plus active.
On la trouve dans les huiles végétales, les noix, les graines, les fruits et les légumes.
Elle agit comme antioxydant, protégeant l’organisme du stress oxydatif et jouant ainsi un rôle important dans la protection des membranes des spermatozoïdes contre les espèces réactives de l’oxygène (ROS) et la peroxydation lipidique. Par conséquent, il a été suggéré que la vitamine E améliore l’activité mitochondriale, réduisant ainsi les dommages causés aux spermatozoïdes et aux mitochondries.
La vitamine C
La vitamine C (acide ascorbique) est une molécule antioxydante hydrosoluble très puissante qui participe également au recyclage de la vitamine E.
On la trouve dans de nombreux fruits frais.
Plusieurs études ont porté sur les effets d’une supplémentation en acide ascorbique sur la fonction spermatique, démontrant que l’administration de vitamine C améliore la qualité du sperme. Le mécanisme responsable de cet effet implique une réduction du stress oxydatif et une amélioration du statut antioxydant, ce qui modifie le microenvironnement testiculaire et stimule la production d’énergie nécessaire à la mobilité des spermatozoïdes.
5. La vitamine D
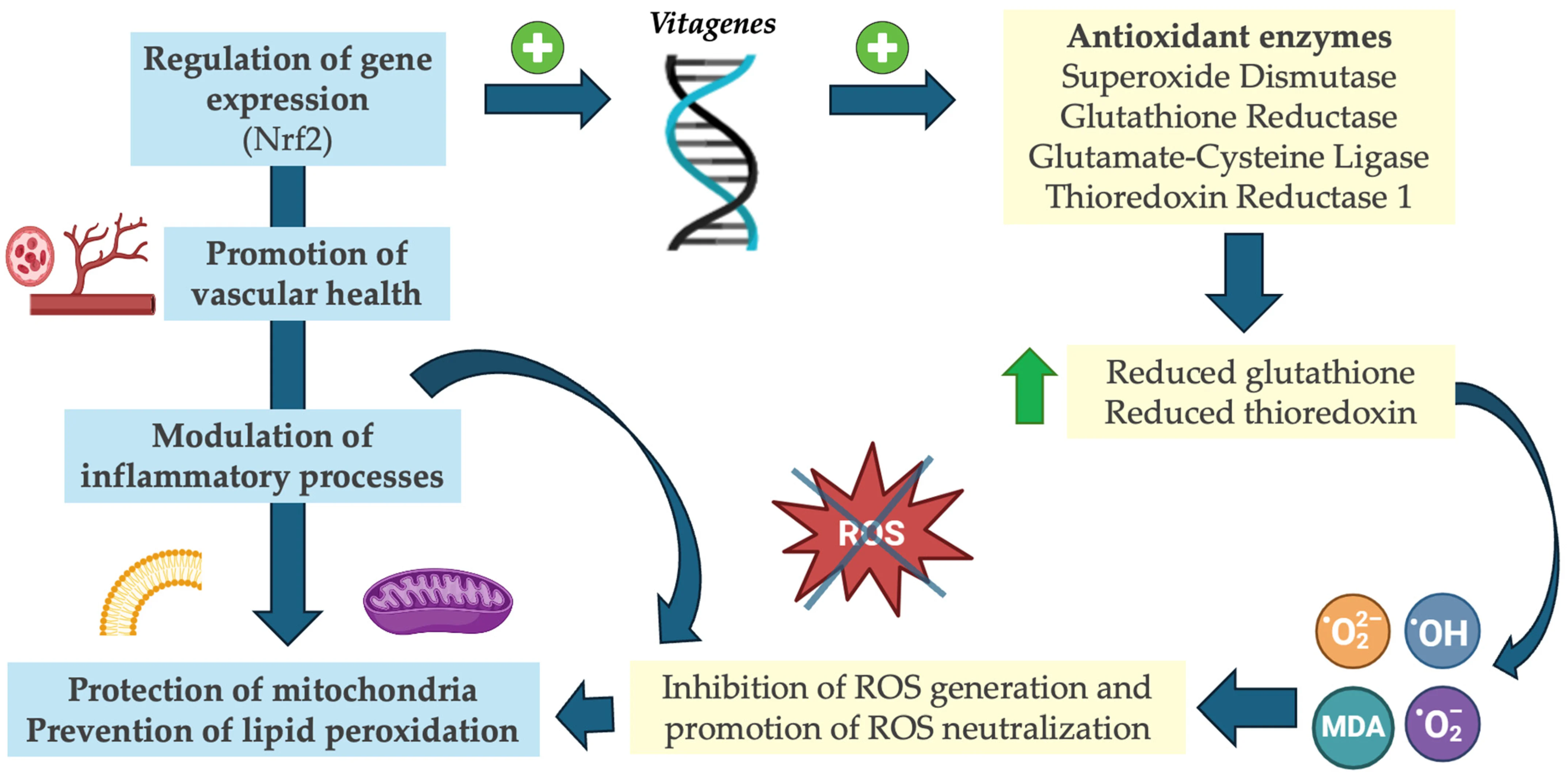
Il a été démontré que la vitamine D influence différents paramètres liés au statut antioxydant. Cette fonction est principalement associée à une augmentation des taux d’enzymes antioxydantes. Ces propriétés antioxydantes plaident fortement en faveur du rôle de la vitamine D dans la promotion de la santé cellulaire et la prévention des dommages oxydatifs.
En se liant au site génomique du VDR, ces composés peuvent moduler l’expression génique.
Fonctions antioxydantes de la vitamine D. Abréviations : MDA, malondialdéhyde ; Nrf2, facteur nucléaire érythroïde 2 lié au facteur 2 ; • OH, radicaux hydroxyles ; • O 2 − , superoxydes radicaux ; • O 2 2− , peroxyde d’hydrogène ; ROS, espèces réactives de l’oxygène.
6. Conclusions
L’alimentation pourrait être un facteur déterminant et modifiable de la fertilité masculine. Il est donc essentiel de souligner l’importance d’un apport quotidien en nutriments pour préserver la fertilité masculine ou prévenir l’infertilité. Une alimentation saine, riche en végétaux et en poisson, est positivement corrélée à la qualité du sperme.
La quantité et la qualité des nutriments ingérés peuvent affecter la qualité du sperme en agissant sur son métabolisme énergétique.
Les régimes riches en acides gras saturés (AGS) et pauvres en acides gras polyinsaturés (AGPI), ou présentant un rapport oméga-6/oméga-3 déséquilibré, ont un impact négatif sur la qualité du sperme, tandis qu’une supplémentation en acides gras insaturés l’améliore.
Si un excès de glucides simples nuit à la fonction spermatique, aucune étude n’a porté sur le rôle des glucides complexes sur la fertilité masculine.
Un régime pauvre en protéines, ainsi qu’une carence en certains acides aminés spécifiques, sont considérés comme des facteurs de risque potentiels d’infertilité masculine.
Les lipides, les glucides et les protéines influencent la qualité du sperme en agissant sur le stress oxydatif et les taux de testostérone, dont la cible commune est la mitochondrie. Organites essentiels au bon fonctionnement des spermatozoïdes, les mitochondries sont impliquées dans la production d’énergie, l’homéostasie des espèces réactives de l’oxygène (ROS) et la biosynthèse des hormones stéroïdiennes. Par conséquent, toute molécule susceptible d’influencer leur fonctionnement peut avoir un impact sur la fertilité masculine. Parmi ces molécules, les acides gras alimentaires et les polyphénols naturels modulent la fonction mitochondriale des spermatozoïdes.
Bibliographie
-
Diet and Male Fertility: The Impact of Nutrients and Antioxidants on Sperm Energetic Metabolism. Alessandra Ferramosca and Vincenzo Zara. Int. J. Mol. Sci.2022, 23(5), 2542
-
Micronutrient–Antioxidant Therapy and Male Fertility Improvement During ART Cycles. Marwa Lahimer, Severine Capelle, Elodie Lefranc, Dorian Bosquet, Nadia Kazdar, Anne Ledu, Mounir Agina, Rosalie Cabry, Moncef BenKhalifa. Nutrients2025, 17(2), 324
-
The Role of Dietary Nutrients in Male Infertility: A Review. Mona S. Almujaydil. Life2023, 13(2), 519
-
The Influence of Cholesterol on Membrane Targeted Bioactive Peptides: Modulating Peptide Activity Through Changes in Bilayer Biophysical Properties. Juan M. Giraldo-Lorza, Chad Leidy, Marcela Manrique-Moreno. Membranes2024, 14(10), 220
-
Antioxidant Functions of Vitamin D and CYP11A1-Derived Vitamin D, Tachysterol, and Lumisterol Metabolites: Mechanisms, Clinical Implications, and Future Directions. Héctor Vázquez-Lorente, Lourdes Herrera-Quintana, Laura Jiménez-Sánchez, Beatriz Fernández-Perea, Julio Plaza-Diaz. Antioxidants2024, 13(8), 996
-
Micronutrient–Antioxidant Therapy and Male Fertility Improvement During ART Cycles. Marwa Lahimer, Severine Capelle, Elodie Lefranc, Dorian Bosquet, Nadia Kazdar, Anne Ledu, Mounir Agina, Rosalie Cabry, Moncef BenKhalifa. Nutrients2025, 17(2), 324;