Introduction
 Dans l’intestin humain, il existe plus de 100 000 milliards de bactéries symbiotiques dépassant de loin le nombre de cellules hôtes et constituant en grande partie l’ensemble la flore intestinale. Ce microbiote affectent de multiples fonctions de l’hôte et la stabilité de la flore intestinale est essentielle dans la préventionles infections et de certaines maladies.
Dans l’intestin humain, il existe plus de 100 000 milliards de bactéries symbiotiques dépassant de loin le nombre de cellules hôtes et constituant en grande partie l’ensemble la flore intestinale. Ce microbiote affectent de multiples fonctions de l’hôte et la stabilité de la flore intestinale est essentielle dans la préventionles infections et de certaines maladies.
Divers mécanismes bénéfiques ont été identifiés :
Les patients atteints de cancer ont une immunité compromise à cause de certaines maladies , de la chimiothérapie et de laradiothérapie. Les effets des probiotiques dans cette population peuvent différer de ceux des personnes en bonne santé.
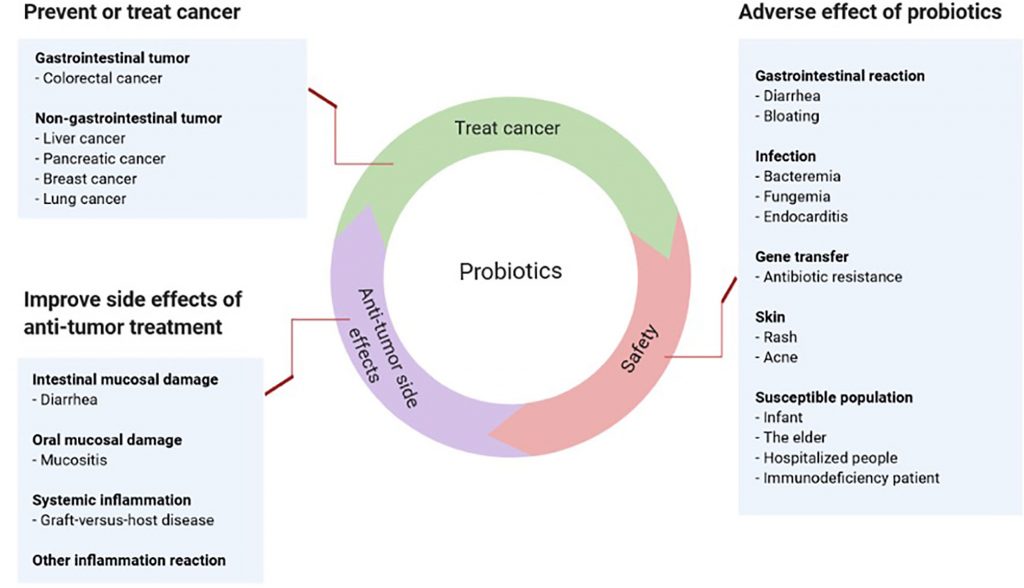
Avantages et inconvénients des probiotiques dans le cancer.
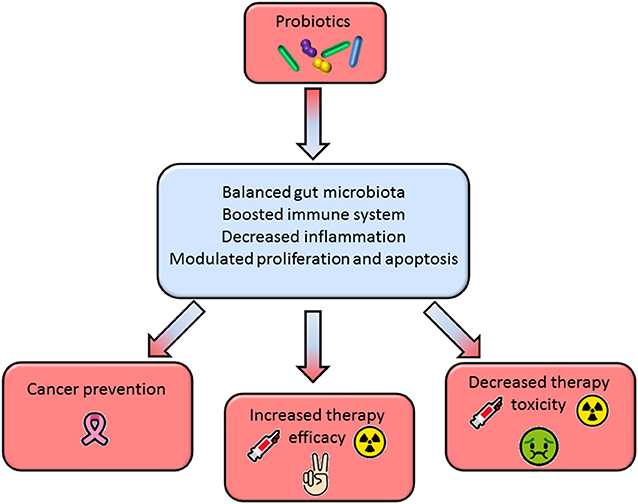
Les probiotiques préviennent et font partie du traitement de certains cancers tes que le cancer colorectal, du foie, du pancréas, du sein et du poumon.
Ils améliorent les effets anti-tumoraux du traitement mais peuvent parfois occasionner des troubles gastro-intestinaux, des infections, une résistance à certains antibiotiques, un rash cutané.
L’effet des probiotiques sur l’hôte
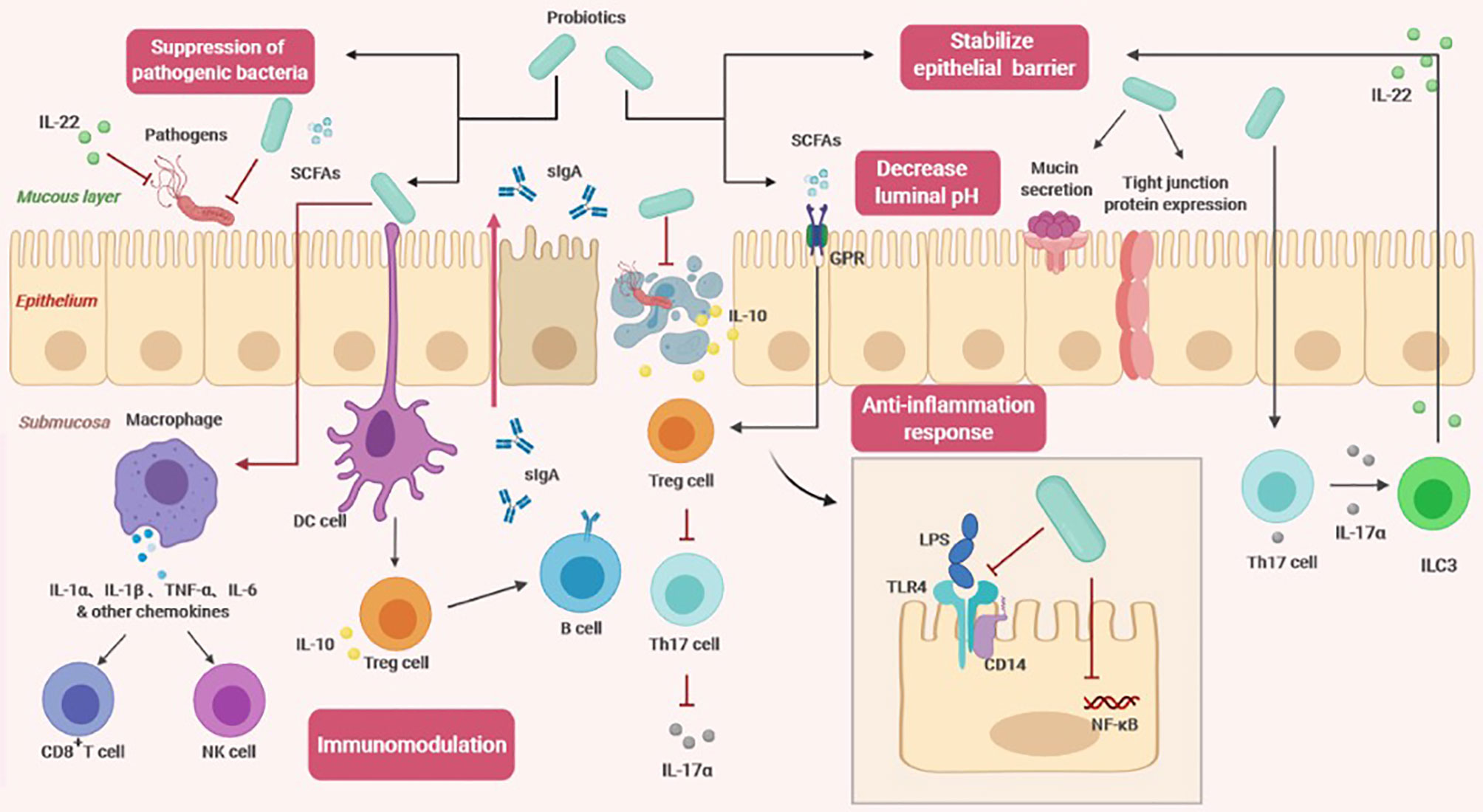
Les probiotiques exercent une variété d’effets bénéfiques sur l’hôte. De plus, leurs métabolites tels que les acides gras à chaîne courte (AGCC) et l’acide lactique, jouent également un rôle important. Ils modulent la physiologie de l’hôte. Le principal avantage des probiotiques est le maintenir d’uneflore intestinale saine permettant de soutenir un système immunitaire sain grâce à des effets physiologiques non spécifiques et spécifiques.
Effets physiologiques non spécifiques
Régulation de la flore intestinale
Les probiotiques permettent de maintenir un bon équilibre de la flore intestinale. Les probiotiques peuvent provoquer des changements dans le nombre total, la diversité et la composition de la flore intestinale.
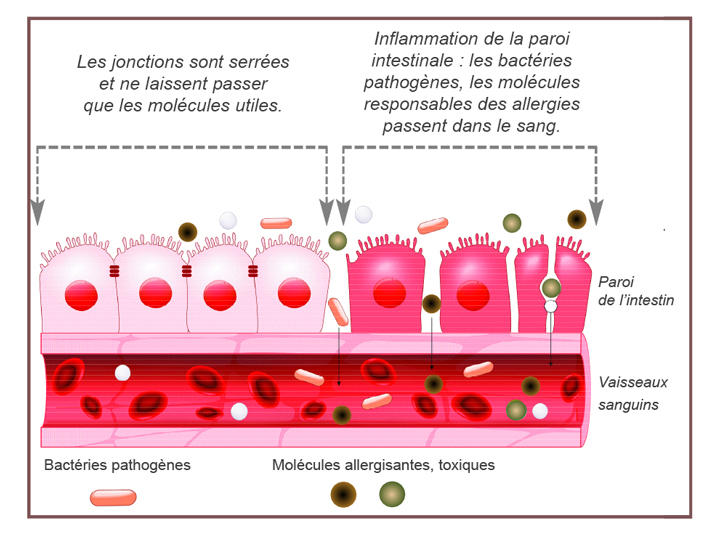
Stabiliser la barrière cellulaire épithéliale intestinale
- Les probiotiques régulent le cytosquelette pour stabiliser la barrière muqueuse et favoriser la sécrétion de mucine pour empêcher la colonisation d’agents pathogènes dans l’épithélium.
- Ils peuvent induire l’expression et la distribution de protéines de jonction serrée. En scellant la partie apicale de l’endothélium, une augmentation de la perméabilité épithéliale et des dommages au niveau de la structure épithéliale sont évités.
- Les probiotiques restaurent une fonctionnalitétransépithéliale détrute par les lipopolysaccharide pathogène (LPS), réduisant ainsi la réponse inflammatoire et l’apoptose excessive.
- Certaines souches probiotiques régulent la polarisation des cellules T auxiliaires 17 (Th17) et induisent efficacement la sécrétion de l’ IL-17α, ce qui déclenche les lymphocytes de type 3 innées (ILC3s) pour produire de l’ IL-22 qui est une cytokine de défense immunitaire clé qui joue un rôle important dans le maintien de l’homéostasie intestinale et la promotion de la guérison et de la régénération tissulaire.
Inhibition des pathogènes
Il existe principalement deux mécanismes distincts d’inhibition des pathogènes.
L’un appartient au système de défense physique.
L’infection des agents pathogènes commence par la colonisation à la surface de la muqueuse intestinale, provoquant des lésions tissulaires. Lorsque les probiotiques occupent complètement l’espace de la paroi intestinale, il n’y a pas d’espace disponible pour les agents pathogènes, et les probiotiques peuvent inhiber davantage l’adhésion des bactéries pathogènes en obtenant plus de nutriments.
L’autre mécanisme est lié aux propriétés antagonistes des probiotiques.
Ils peuvent réduire le pH du microenvironnement en produisant des AGCC qui sont principalement produits par l’utilisation de glucides non digérés par des bactéries anaérobies du côlon, principalement l’acide acétique, l’acide propionique et l’acide butyrique. La forte concentration d’AGCC qui s’accumulent dans le tractus intestinal peut rapidement abaisser le pH. Par rapport aux agents pathogènes, les probiotiques sont plus capables de s’adapter à des environnements à pH plus faible et ont donc un meilleur taux de survie. En plus de modifier la valeur du pH, les probiotiques s’opposent également à l’adhésion et au transport des agents pathogènes.
Effets physiologiques spécifiques
Régulation immunitaire
Les probiotiques peuvent réguler l’immunité humorale, l’immunité innée et l’immunité cellulaire. Les cellules épithéliales intestinales peuvent percevoir et distinguer les bactéries symbiotiques et pathogènes via la production de cytokines et la transduction dusignal. Une fois que les probiotiques sont entrés en contact avec les cellules épithéliales intestinales, les cellules dendritiques (CD) hôtes reconnaissent avec précision les surfaces probiotiques et les molécules effectrices grâce à des récepteurs et corécepteurs de reconnaissance de formes, puis présentent des antigènes aux cellules T régulatrices (Treg) après traitement. L’augmentation du nombre de Tregs favorise la transformation des classes d’anticorps des lymphocytes B et la sécrétion de grandes quantités de sIgA . La production de sIgA est également régulée par des voies indépendantes des cellules T. Ce processus est médié par des récepteurs d’acides gras libres sensibles aux métabolites. Une fois que les AGCC se lient aux récepteurs des acides gras, aidant ainsi à la production de sIgA. De plus, les probiotiques activent la sécrétion de cytokines par les macrophages, celles-ci activent les lymphocytes T nk (les cellules tueuses naturelles) et les cellules T cytotoxiques, qui participent à la réponse immunitaire aux agents pathogènes.
Les probiotiques induisant à la fois des réponses anti-inflammatoires et pro-inflammatoires. Bien que cela puisse sembler contradictoire à première vue, cela indique que les probiotiques ont un effet équilibrant important sur l’homéostasie intestinale dans différents contextes.
Le rôle des probiotiques dans la réponse anti-inflammatoire est lié à leur capacité à réguler les récepteurs Toll-like (TLR) et les GPR.
Effets de l’hôte sur les probiotiques
La même souche a des effets différents sur la physiologie de l’hôte. A la différence des médicaments, l’efficacité des probiotiques varie considérablement d’un individu à l’autre. L’âge, la condition physique, la composition microbienne intestinale, l’autorisation de colonisation et le régime alimentaire de l’hôte contribuent tous à l’hétérogénéité de l’effet.
Chez les patients cancéreux, après avoir subi des traitements tels que la chimiothérapie, la radiothérapie ou la chirurgie, les conditions médicales sous-jacentes telles que la cachexie combinée à des effets secondaires liés au traitementet le microenvironnement sont plus compliqués et peuvent directement conduire à la destruction de la barrière muqueuse intestinale et au dysfonctionnement du système immunitaire. Les changements ci-dessus ne sont pas propices à la colonisation de probiotiques bénéfiques dans l’intestin.
Même si les probiotiques utilisés sont bénéfiques, la barrière de colonisation affectera grandement l’effet thérapeutique.
La microécologie intestinale est composée de flore intestinale, de prébiotiques, des nutriments ingérés, qui se complètent. Par conséquent, les probiotiques ont besoin d’un environnement approprié pour fonctionner. Une variété d’aliments sont nécessaires pour maintenir une flore saine tels que les glucides fermentescibles qui favorisent la colonisation et la croissance de bactéries bénéfiques dans l’intestin. Les fibres alimentaires stimulent la croissance et l’activité des bactéries bénéfiques et peuvent réduire l’acide gastrique pour protéger les probiotiques, leur permettant de passer en douceur dans l’intestin. Les acides gras polyinsaturés régulent l’adhésion des probiotiques. Chez les patients cancéreux, en plus des facteurs individuels, les difficultés alimentaires et la survenue de malnutrition accélèrent l’effondrement de l’homéostasie intestinale induit par le cancer. Dans ce cercle vicieux, l’effet thérapeutique des probiotiques est fortement réduit.
Des probiotiques pour prévenir et traiter le cancer
Dans toutes les études, les probiotiques était représenté par une ou plusieurs souches bactériennes, surtout des bactéries lactiques ; néanmoins, des levures non pathogènes, telles que Saccharomyces boulardii , peuvent également être classées dans la famille des probiotiques. L’ administration quotidienne de S. boulardii à des souris APC Min réduisait significativement le nombre et la taille des tumeurs et le grade de la dysplasie.
Les souches microbiennes spécifiques peuvent être utilisées seules ou en combinaison avec des agents de traitement du cancer. L’objectif du traitement a été atteint en activant la surveillance immunitaire contre le cancer.
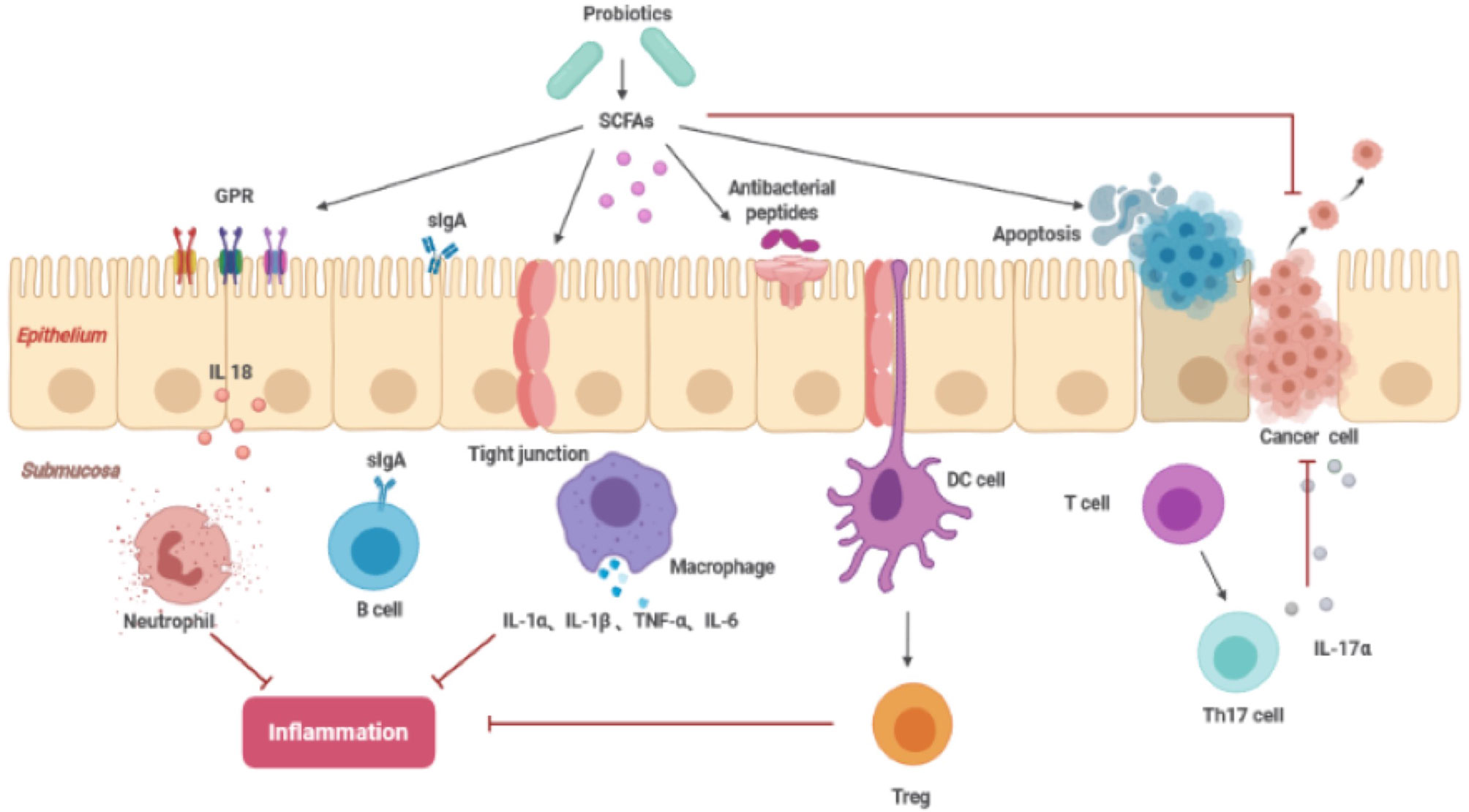
Rôle des AGCC
- Les AGCC sont la source d’énergie des cellules du côlon, maintenant l’environnement acide de l’intestin inhibant la formation de niveaux élevés d’acides biliaires secondaires et favorisant l’acidose et l’apoptose des cellules cancéreuses. Parmi eux, l’acide butyrique permet d’équilibrer la prolifération, la division et l’apoptose des cellules du côlon.
- Bien que les AGCC soient dérivés de la flore intestinale, en raison de différences individuelles, la quantité produite peut ne pas être suffisante pour inhiber le développement du cancer colorectal. Par conséquent, la consommation de probiotiques peut aider à augmenter la production quotidienne d’AGCC.
- La présence d’AGCC peut inhiber la croissance des agents pathogènes.
- De plus, les AGCC peuvent également réguler l’immunité intestinale locale et la réponse immunitaire systémique.
- Les AGCC induisent les cellules épithéliales intestinales à produire des peptides antibactériens et améliorent l’expression des jonctions serrées pour stabiliser la fonction de la barrière intestinale.
- Les AGCC affectent l’inflammation en interagissant avec les récepteurs couplés aux protéines G dans l’intestin et en équilibrant la réponse immunitaire : rôle immunomodulateur.
- L’acide linoléique conjugué (CLA) est un isomère de l’acide linoléique (LA), et les deux isomères peuvent induire l’expression de gènes d’apoptose, notamment Bcl-2, la caspase 3 et la caspase 9, inhibant la propagation des cellules cancéreuses du côlon. Les Lactobacillus, Bifidobacterium, Streptococcus salivarius et Propionibacterium freudenreichiipeuvent produisent du CLA dans l’iléon terminal, qui peut être absorbé par les cellules du côlon ou interagir avec lui pour exercer ses effets bénéfiques.
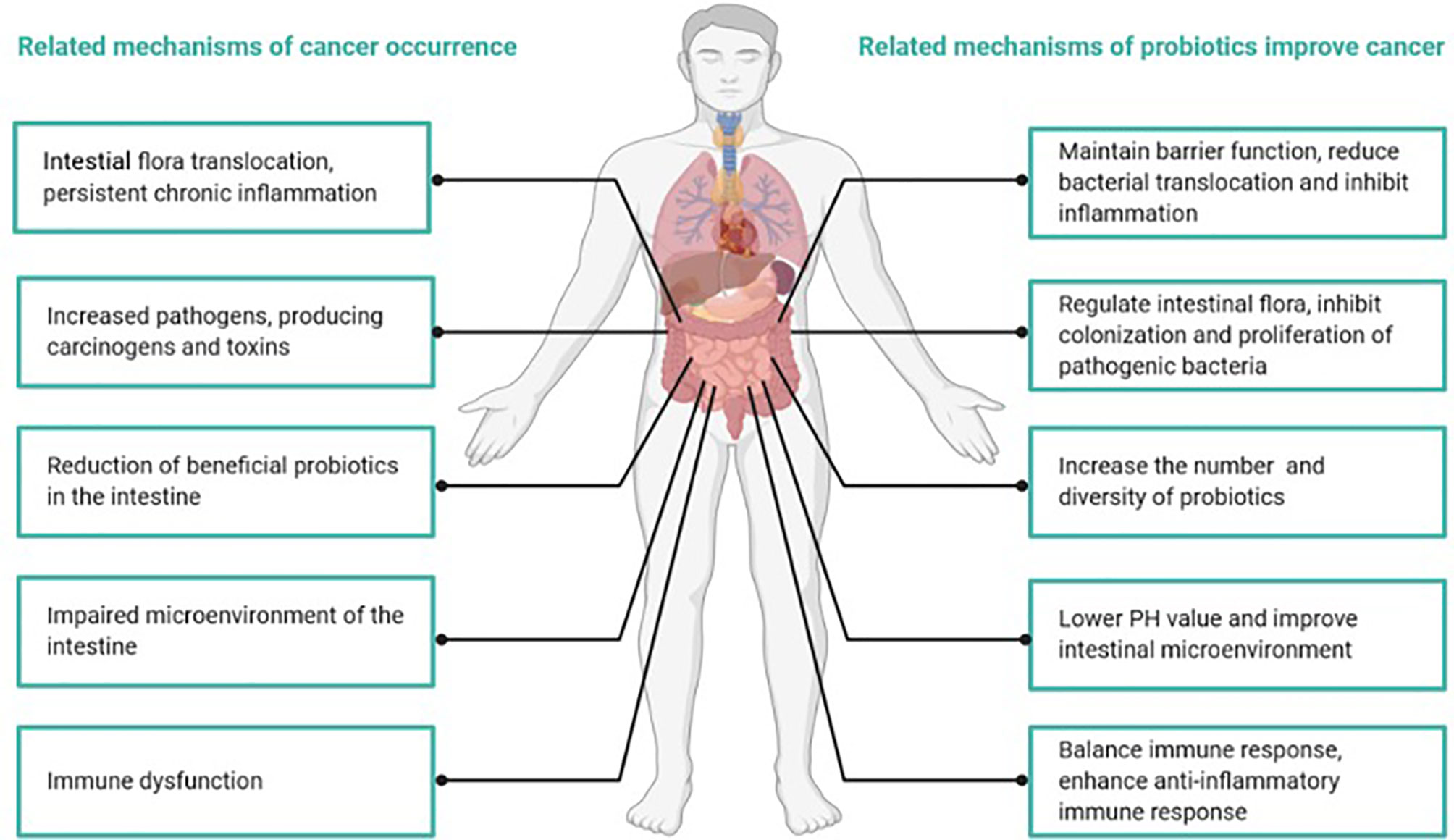
Mécanismes de survenue du cancer et comment les probiotiques atténuent le cancer.
Des études ont indiqué que les mécanismes anticancéreux des probiotiques comprennent principalement une régulation positive de la flore intestinale, des modifications de l’activité métabolique, la liaison et la dégradation de composés cancérigènes, l’immunomodulation pour améliorer l’inflammation chronique, l’abaissement du pH intestinal et l’inhibition des enzymes qui produisent des composés potentiellement cancérigènes.
Effets protecteurs du LcS contre différents types de cancer
L’une des souches probiotiques les plus connues et les plus étudiées est Lactobacillus casei Shirota(LcS), un micro-organisme offrant de nombreux effets bénéfiques pour la santé, renforçant principalement le système immunitaire de l’hôte et prévenant les maladies intestinales infectieuses.
- Diminution de la carcinogenèse en termes d’incidence et de multiplicité des tumeurs, probablement en augmentant le nombre de lymphocytes T

Lactobacillus-casei-Shirota cytotoxiquesdans un modele de cancer du colon chez le rat.
- La consommation régulière de LcS, sans affecter la survenue de nouvelles tumeurs, réduisait significativement les atypies modérées et sévères chez des patients japonais ayant des antécédents d’au moins deux cancers colorectaux.
- Un apport régulier de LcS en association avec des isoflavones de soja depuis l’adolescence était protecteur contre le risque de cancer du sein.
- Le Lactobacillus plantarum LS/07 ralenti la croissance des tumeurs mammaires chez les rats ytaités par le 7,12-diméthylbenz[a]anthracène. L’administration quotidienne de cette souche avant et après l’induction du cancer a significativement diminué la fréquence des tumeurs, augmenté les CD4 + et CD8 +produites par les cellules T dans les tissus tumoraux et diminution du TNFα dans le sérum.
Optimalisation des thérapies anticancéreuses grâce aux probiotiques.
Les probiotiques soutiennent la chimiothérapie et améliorent la réponse pharmacologique.
Les probiotiques améliorent également les résultats des protocoles d’immunothérapie anti-cancer. Une taille tumorale nettement réduite, une expression réduite de Ki67, une apoptose accrue, une inhibition du potentiel métastatique et le passage d’un microenvironnement immunosuppresseur à un microenvironnement immunostimulant ont été observés dans le traitement combiné par rapport à l’immunothérapie seule.
Une étude préliminaire très récente suggère cependant que la prise de suppléments de probiotiques chez les patients atteints de mélanome réduit de 70 % la réponse à l’immunothérapie anti-PD1, diminuant probablement la diversité du microbiote intestinal. Ces résultats controversés, qui entrent en conflit avec la perception générale des probiotiques comme étant bénéfiques et avec les résultats antérieurs, méritent des investigations plus approfondies.
Diminution de la toxicité des thérapies anticancéreuses
 Les probiotiques sont prometteurs pour soulager certains effets indésirables associés aux traitements anticancéreux conventionnels, qui nécessitent souvent d’augmenter les doses de médicaments et de retarder ou d’arrêter les thérapies. Les lésions intestinales représentent une complication majeure des chimiothérapies et des radiothérapies, se présentant principalement sous la forme de diarrhée et de mucite : une affection inflammatoire/ulcéreuse douloureuse de la muqueuse.
Les probiotiques sont prometteurs pour soulager certains effets indésirables associés aux traitements anticancéreux conventionnels, qui nécessitent souvent d’augmenter les doses de médicaments et de retarder ou d’arrêter les thérapies. Les lésions intestinales représentent une complication majeure des chimiothérapies et des radiothérapies, se présentant principalement sous la forme de diarrhée et de mucite : une affection inflammatoire/ulcéreuse douloureuse de la muqueuse.
La supplémentation quotidienne en L. rhamnosus GG chez les patients atteints de cancer colorectal au cours d’une chimiothérapie adjuvante à base de 5-FU diminue la diarrhée sévère, l’inconfort abdominal et la nécessité de réduire les doses de chimiothérapie chez les patients ne recevant pas de probiotiques.
Une réponse inflammatoire plus légère et une atténuation de la dysbiose ont été observées lors du traitement par probiotique.
L’irinotécan, administré pour traiter le cancer colorectal avancé conduit fréquemment à une toxicité intestinale. Les patients prenant des probiotiques quotidiennement pendant la chimiothérapie avaient moins d’incidence et de gravité de la diarrhée, et moins d’entérocolite et de ballonnements.
L’apport de probiotiques chez les patients subissant une radiothérapie adjuvante pour un cancer de l’intestin ou du col de l’utérus a significativement diminué l’occurrence, l’incidence et la gravité de la diarrhée et le nombre de selles quotidiennes de l’entérocolite et a retardé l’utilisation de médicaments antidiarrhéiques.
La chimiothérapie et la radiothérapie peuvent également entraîner des mucites dans les régions oropharyngées, cet événement est très fréquent chez les patients traités pour des cancers de la tête et du cou.L’administration de probiotiques pendant et après la fin du traitement a diminué l’incidence et la sévérité de la mucite buccale et a permis à un plus grand nombre de patients de terminer le traitement anticancéreux par rapport au groupe placebo.
Evaluation de l’innocuité des probiotiques
L’un des problèmes théoriques les plus importants dans l’utilisation clinique des probiotiques est la bactériémie, tandis que les infections fongiques causées par les levures sont encore plus difficiles à traiter. L’intégrité intestinale compromise et la translocation des probiotiques en sont les principales causes. Les données génomiques ont confirmé que ces effets indésirables étaient en effet liés aux probiotiques ingérés plutôt qu’aux probiotiques colonisés dans l’intestin. Il a été constaté que pour les patients dont la fonction immunitaire était altérée, le risque d’infection était plus élevé.
 Les infections causées par les lactobacilles et les bifidobactéries sont extrêmement rares représentant 0,05 % à 0,4 % du total des cas d’endocardite infectieuse et de bactériémie. La plupart des patients avaient des maladies sous-jacentes graves . En plus d’être lié à des facteurs individuels, le risque d’infection était également lié au type et à la dose des probiotiques. Les Lactobacilus sont plus susceptible de provoquer une infection par rapport aux Bifidobactéries.
Les infections causées par les lactobacilles et les bifidobactéries sont extrêmement rares représentant 0,05 % à 0,4 % du total des cas d’endocardite infectieuse et de bactériémie. La plupart des patients avaient des maladies sous-jacentes graves . En plus d’être lié à des facteurs individuels, le risque d’infection était également lié au type et à la dose des probiotiques. Les Lactobacilus sont plus susceptible de provoquer une infection par rapport aux Bifidobactéries.
Des études rétrospectives ont démontré que les souches probiotiques tels que les Bifidobacterium et les Lactobacillus n’ont eu aucun effet indésirable grave avec une posologie quotidiennes ne dépassaient pas 5,0 × 10 10 CFU/jour, la médiane était de 2,0 × 10 9 CFU/jour. Les résultats ont montré qu’il était sûr d’utiliser des probiotiques chez les patients présentant une fonction immunitaire altérée
Conclusions et perspectives d’avenir
Dans un certain nombre d’essais évaluant les effets protecteurs des probiotiques sur les effets secondaires liés au traitement antitumoral, l’utilisation combinée de souches probiotiques a eu un effet protecteur positif pour les patients en ce qui concerne certaines fonctions immunitaires. Cependant, pour les patients dont la fonction immunitaire est gravement altérée, en particulier les patients atteints de neutropénie, un examen attentif est nécessaire.
En raison de la pathogenèse complexe des tumeurs, différents patients reçoivent différentes options de traitement et différentes souches affecteront les résultats.
L’identification des souches les plus bénéfiques pour la prévention et le traitement de différents types de cancer nécessite une base de données humaine très étendue, et il est nécessaire d’analyser soigneusement les corrélations entre les différentes souches et les réponses cliniques.
Pour le cancer comme pour d’autres maladies, la régulation de la flore humaine ciblée est susceptible de devenir un nouveau domaine de médecine de précision et personnalisée à l’avenir.
Bibliographie
- Microbiota Manipulation by ProbioticsAdministration as Emerging Tool in Cancer Prevention and Therapy. Concetta Panebianco, Tiziana Latiano and Valerio Pazienza. MINI REVIEW article. Front. Oncol., 22 May 2020
- Probiotics in Cancer. Ke Lu, Shanwu Dong, Xiaoyan WU, Runming Jin, Hongbo Chen. REVIEW article. Front. Oncol., 12 March 2021