1. Introduction
L’infertilité féminine est une affection médicale et sociale globale causée par diverses altérations physiopathologiques. Outre le vieillissement, un certain nombre de facteurs non modifiables liés au mode de vie, tels que le tabagisme, une consommation élevée de caféine et d’alcool, le stress, les sports agonistes, l’exposition chronique aux polluants environnementaux et d’autres habitudes nutritionnelles ont un impact négatif sur la fertilité des femmes.
Les interactions gènes-nutriments contribuent de manière essentiels à la gestion de la santé et sont donc également importantes dans le domaine de la fertilité. La nutrigénomique et la nutrigénétique sont des sciences qui étudient la relation entre les variations génétiques et les besoins en nutriments. Les nutriments peuvent entraîner des changements épigénétiques c’est àdirequ’ils peuvent moduler l’expression des gènes sans modifier leur structure.
La nutrition peut altérer l’expression des gènes intervenant dans la fertilité.
2. Infertilité
On estime que l’infertilité touche 8 à 16 % des couples en âge de procréer dans le monde. La prévalence des cas d’infertilité féminine a augmenté à un rythme effrayant, affectant environ 48 millions de femmes à travers le monde.
Le mode de vie et les facteurs nutritionnels se sont avérés être des éléments importants de la fonction reproductive normale. La consommation d’acide folique est recommandée pour la prévention des anomalies du tube neural et s’est avérée être liée à une fréquence plus faible d’infertilité et à un risque plus faible de fausse couche. D’autres composants nutritionnels ou types de régime ont été étudiés en relation avec l’infertilité féminine, notamment le régime méditerranéen, les graisses, les vitamines, la caféine, le tabagisme, l’alcool et, plus récemment, les probiotiques.
2.1. Diète méditerranéenne
Le régime méditerranéen est un régime riche en légumes, fruits, grains entiers, légumineuses, noix et huile d’olive et pauvre en viande rouge. Il s’est avéré bénéfique dans plusieurs aspects de la santé humaine en général et également dans le cadre de la fertilité. L’adhésion au régime méditerranéen est associée à un risque plus faible d’infertilité ovulatoire ainsi qu’une probabilité plus élevée de grossesse et de naissances vivante.
2.2. Les acides gras
Les acides gras oméga-3 à longue chaîne améliorent l’infertilité féminine. Les acides gras monoinsaturés(AGMI) sont associés à une fécondabilité accrue ou à un délai plus court jusqu’à la grossesse. Les acides gras affectent la fécondabilité en modifiant la sensibilité à l’insuline et l’inflammation car ces voies influencent également la fonction ovulatoire.
2.3 La vitamine D
Un niveau optimal de concentration de vitamine D dans le sérum sanguin devrait se situer entre 50 et 125 nmol/L, certaines études environnementales indiquent que le niveau cible devrait être fixé beaucoup plus haut – jusqu’à 250, voire à 300 nmol/L. Sa structure chimique ressemble à celle des hormones stéroïdes et il agit égalementvia le récepteur nucléaire (VRE).
La vitamine D stimule également la production d’hormone anti-Müllerienne (AMH), qui est fortement corrélée à la préservation de la réserve ovarienne.
Chez les patientes présentant une carence en vitamine D, une fréquence plus élevée de myomes utérins est observée, une autre raison établie d’infertilité.
Effet de la vitamine D sur la fécondation in vitro
 Les niveaux de VD chez les patientes présentant une grossesse clinique sont significativement plus élevéspar rapport à celles ayant subi un avortement spontané précoce. Les patientes avec des niveaux de VD initiaux élevés (267,8 ± 66,4 nmol/L) avaient quatre fois plus de chances de réussir la procédure de FIV par rapport au groupe avec de faibles niveaux de VD (104,3 ± 21 nmol/L).
Les niveaux de VD chez les patientes présentant une grossesse clinique sont significativement plus élevéspar rapport à celles ayant subi un avortement spontané précoce. Les patientes avec des niveaux de VD initiaux élevés (267,8 ± 66,4 nmol/L) avaient quatre fois plus de chances de réussir la procédure de FIV par rapport au groupe avec de faibles niveaux de VD (104,3 ± 21 nmol/L).
Après une analyse croisée comprenant le nombre et la qualité des embryons transférés, il a été démontré que les patients présentant des niveaux de VD appropriés ont quatre fois plus de chances de réussir la procédure.
Les taux finaux de naissances vivantes étaient de 31 % chez les receveurs carencés en vitamine D contre 59 % chez les receveurs dont les taux en vitamine D étaient optimaux. Les effets de la vitamine D peuvent être médiés entre autre par l’endomètre de qualité et non par le follicule ou l’ovocyte.
Des taux sériques élevés de VD et de leurs dérivés sont retrouvés dans la caduque humaine dès le 1er trimestre de la grossesse, ce qui suggère fortement sa contribution au processus d’implantation. La synthèse de 1-25 OH VD par les cellules endométriales est plus élevée au 1er trimestre par rapport au 3e trimestre. Le rôle immunomodulateurde la vitamine D dans le preocessus d’implantation et du maintient d’une grossesse à terme a été confirmé.
Les patiente envidageant une grossesse devraient être substituées en vitamine D puisqu’aucun effet indésirable n’a été signalé pour un apport en vitamine D allant jusqu’à 10 000 UI/j.
2.4 Le stress oxydatif
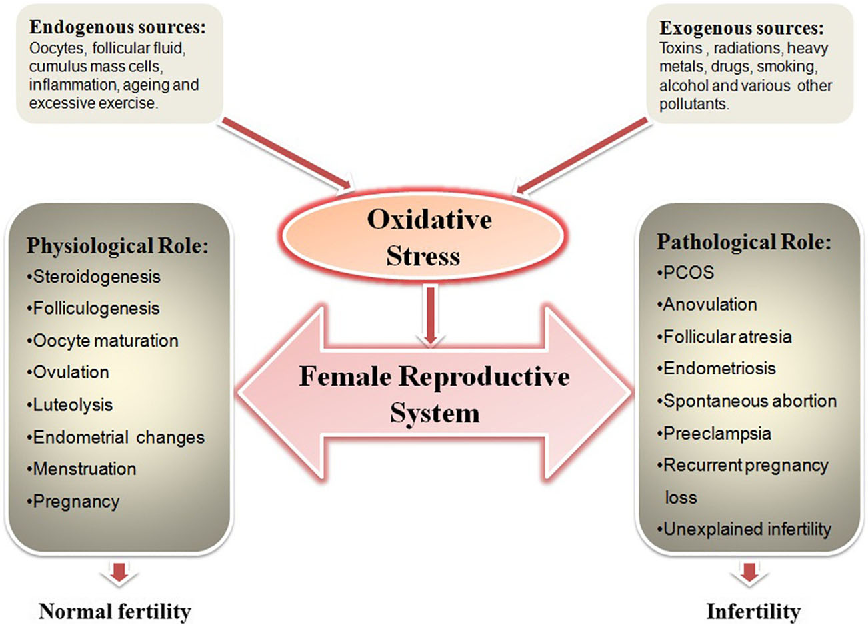
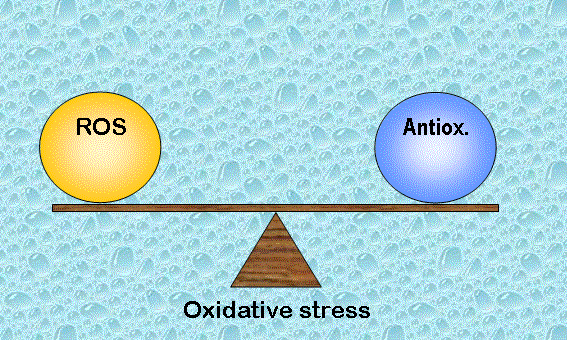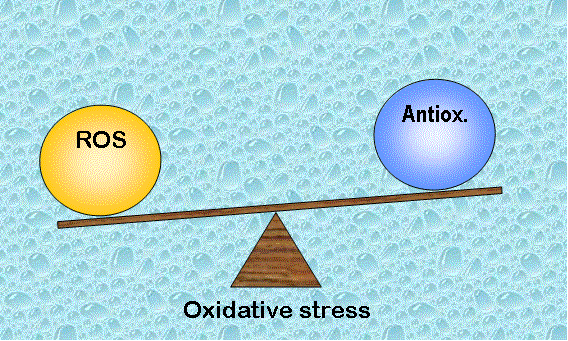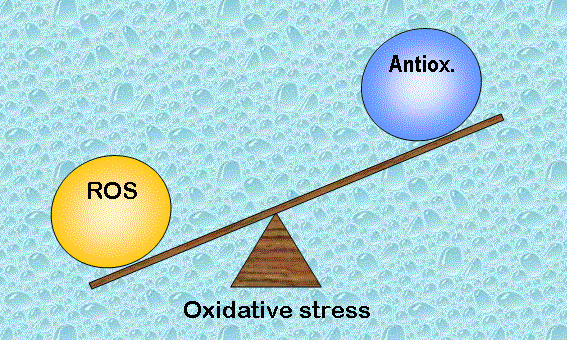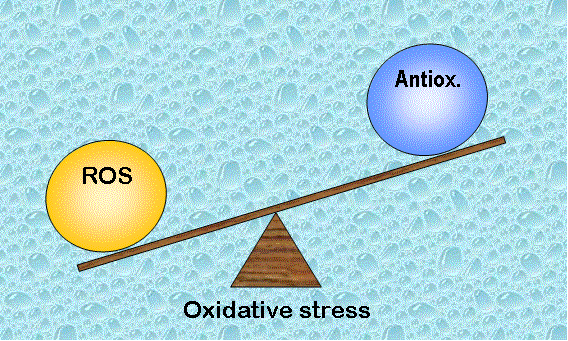 Un seuil de radicaux libres (ROS) facilite les fonctions physiologiques vitales du système reproducteur, mais une quantité excessive de ROS entraîne des dysfonctionnements contribuant à l’infertilité.
Un seuil de radicaux libres (ROS) facilite les fonctions physiologiques vitales du système reproducteur, mais une quantité excessive de ROS entraîne des dysfonctionnements contribuant à l’infertilité.
Chez les hommes, les niveaux physiques de ROS sont essentiels pour la maturation, la capacitation, l’hyperactivation, la réaction acrosomique et la fécondabilité des spermatozoïdes. Cependant, un niveau supraphysiologique de ROS engendre une peroxydation lipidique, la fragmentation de l’ADN des spermatozoïdes, l’apoptose des cellules germinales, et donc l’infertilité. La motilité ainsi que la viabilité des spermatozoïdes, la capacité de fécondation sont inactivés par le stress oxydatif dans les tissus reproducteurs, en effet, des niveaux significativement plus élevés de ROS ont été observés dans le sperme des hommes infertiles.
Chez la femme, un grand nombre de follicules commencent à se développer et grandissent dans l’ovaire chaque mois, mais un seul d’entre eux atteint la maturité, le follicule dominant. Ce processus est rendu possible grâce à un équilibre entre les antioxydant et la production de ROS.
Le follicule en croissance produit des stéroïdes entraînant une augmentation de la cytochrome P450 qui, à son tour conduit à la production de ROS. Les ROS produits par les follicules préovulatoires sont des inducteurs essentiels de l’ovulation. Les ROS sont également générés dans le corpus luteum et sont donc considérés comme des facteurs clés pour la reproduction. En outre, les ROS peuvent influencer le développement de l’embryon dans sa phase précoce en manipulant les principaux facteurs transcriptionnels et en modifiant ainsi l’expression des gènes. La concentration de ROS peut également jouer un rôle important dans la fécondation des œufs et l’implantation.
De plus, de nombreuses études ont montré que les niveaux régulés de radicaux libres dans les ovaires, les trompes de Fallopes, l’endomètre, l’embryon et le liquide péritonéal ont un rôle important dans la stéroïdogenèse ovarienne, la folliculogenèse, la signalisation hormonale, le remodelage tissulaire, la maturation des ovocytes, le fonctionnement des trompes de Fallope ainsi que les changements cycliques de l’endomètre.
Le stress oxydatif affecte la maturation de l’ovocyte, la fécondation, l’ovulation, le cycle menstruel, l’embryon et la grossesse. Il peut être également responsable de fausses couches spontanées ainsi que de la prééclampsie.
Le stress oxydatif est impliqué dans la pathogénèse de l’endométriose, du syndrome des ovaires micropolykystiques (PCOD), l’infertilité inexpliquée et l’infertilité en lien avec des facteurs tubaires et péritonéaux.
Si la fécondation se produit, l’induction de l’apoptose par le stress oxydatif peut entraîner l’avortement, la fragmentation de l’embryon, l’échec de l’implantation, une placentation anormale ainsi que des anomalies congénitales.
L’excès de radicaux libres peut affecter les fonctions l’endomètre dont le rôle physiologique est de soutenir l’embryon et son développement.
Le stress oxydatif provoque une régression du corps jaune et par conséquent, entraîne un apport hormonal insuffisant pour le maintien de la grossesse.
2.5 Les probiotiques
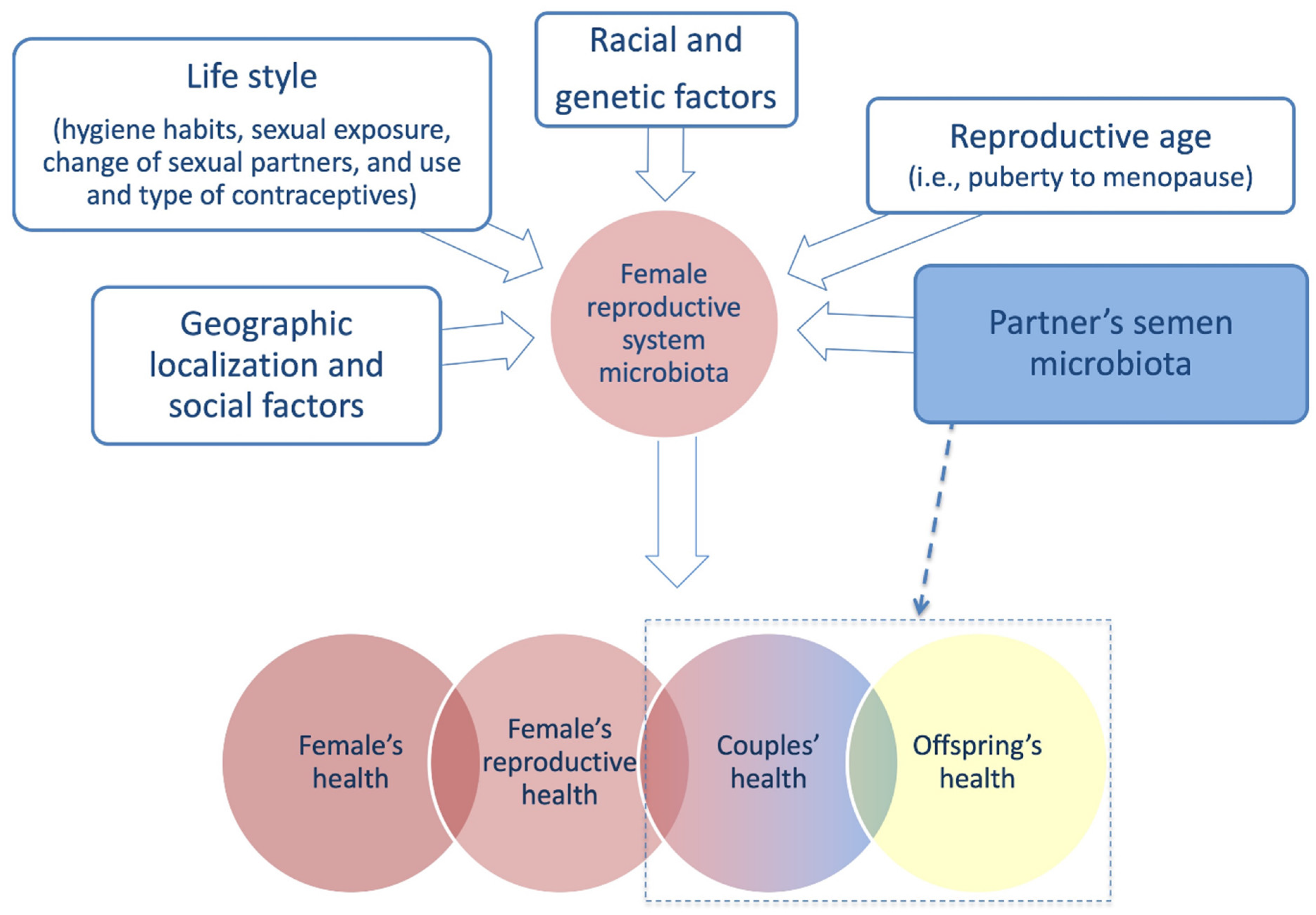
 De plus en plus d’études soulignent l’importance du microbiote féminin dans la reproduction humaine et la fertilité. Plusieurs facteurs peuvent affecter le microbiomedu système reproducteur féminin et doivent être pris en considération.
De plus en plus d’études soulignent l’importance du microbiote féminin dans la reproduction humaine et la fertilité. Plusieurs facteurs peuvent affecter le microbiomedu système reproducteur féminin et doivent être pris en considération.
L’évaluation de la composition du microbiote du sperme du partenaire est importante car elle a des implications non seulement sur la composition du microbiome vaginal mais affecte également la fertilité du couple et la santé de leur descendance.
Dans un bilan d’infertilité, l’évaluation du microbiote du partenaire masculin est impérative. Les systèmes reproducteurs des deux partenaires fonctionnent de manière coordonnée. Il serait donc utile de tester le microbiote dans l’évaluation de l’infertilité des couples afin de planifier le traitement le plus approprié et le plus personnalisé. En effet, le microbiome offre une opportunité unique de développer des traitements spécifiques visant à sa modification, cela ouvrira la voie à de nouvelles opportunités pour la gestion et le traitement de l’infertilité.
Conclusion
Un bon équilibre de protéines, glucides, lipides, antioxydants et vitamines dans l’alimentation quotidienne apporte un bénéfice essentiel pour une santé reproductive féminine optimale et réduit le risque d’infertilité.
Bibliographie
- Nutrition in Gynecological Diseases: CurrentPerspectives. Michal Ciebiera, Sahar Esfandyari, Hiba Siblini, Lillian Prince, Hoda Elkafas,Cezary Wojtyla, Ayman Al-Hendy, Mohamed Ali. Nutrients 2021, 13(4), 1178; https://doi.org/10.3390/nu13041178
- Omega-3 fatty acid supplementationand fecundability. Jamie Stanhiser MD, Anne Marie Jukic PhD, Anne Z. Steiner MD, MPH. Fertility and Sterility. ORAL SESSION| VOLUME 112, ISSUE 3, SUPPLEMENT , E28, SEPTEMBER 01, 2019. DOI:https://doi.org/10.1016/j.fertnstert.2019.07.205
- The Role of Vitamin D in Reproductive Health—A Trojan Horse or the Golden Fleece? Filip Dąbrowski, Barbara Grzechocińska, MirosławWielgoś. Nutrients 2015, 7(6), 4139-4153; https://doi.org/10.3390/nu7064139
- Ameliorating Effects of Natural AntioxidantCompounds on Female Infertility: a Review. Jitender Kumar Bhardwaj, Harish Panchal & Priyanka Saraf. Reproductive Sciences. https://doi.org/10.1007/s43032-020-00312-5
- Microbiota and Human Reproduction: The Case of Female Infertility. Rossella Tomaiuolo, IolandaVeneruso, Federica Cariati and Valeria D’Argenio. High-Throughput 2020, 9(2), 12; https://doi.org/10.3390/ht9020012
- Nutrition and Female Fertility: An Interdependent Correlation. Erica Silvestris,Domenica Lovero and Raffaele Palmirotta.REVIEW article. Front. Endocrinol., 07 June 2019. https://doi.org/10.3389/fendo.2019.00346