Introduction
 Des études ont démontré que l’exercice physique joue un rôle dans la prévention du cancer car il réduit son incidence ainsi que sa récurrence. L’effet de l’exercice avant la détection de la tumeur semble être tout aussi efficace pour inhiber la croissance tumorale. Cela suggère que l’activité physique offre une protection contre le développement de tumeurs ; cependant.
Des études ont démontré que l’exercice physique joue un rôle dans la prévention du cancer car il réduit son incidence ainsi que sa récurrence. L’effet de l’exercice avant la détection de la tumeur semble être tout aussi efficace pour inhiber la croissance tumorale. Cela suggère que l’activité physique offre une protection contre le développement de tumeurs ; cependant.
L’exercice physique peut avoir un effet antitumoral :
- en régulant le profil métabolique, augmentant la sensibilité de l’organisme à l’insuline contribuant ainsi à l’homéostasie du glucose,
- en diminuant les niveaux d’hormones stéroïdes sexuelles,
- en améliorant la réponse immunitaire, y compris la réduction de l’inflammation ou la sécrétion de myokines du muscle squelettique qui inhibent la croissance tumorale.
Après l’exercice, les adaptations métaboliques des muscles squelettiques sont dues à leurs besoins énergétiques accrus et comprennent la régulation des voies liées à l’énergie et au glucose-insuline par les myokines, les hépatokines et les adipokines sécrétées par le muscle squelettique, le foie et le tissu adipeux, respectivement lors de l’exercice. Par exemple, la myokine interleukine 6 (IL6) augmente le métabolisme des lipides et la génération de glucose dans les hépatocytes et améliore la sécrétion d’insuline par le pancréas.
De même, les altérations métaboliques des cellules cancéreuses sont une caractéristique importante de la progression tumorale qui sont déterminées par :
- des caractéristiques intrinsèques aux cellules telles que le tissu d’origine,
- les mutations génétiques
- le stade de la maladie.
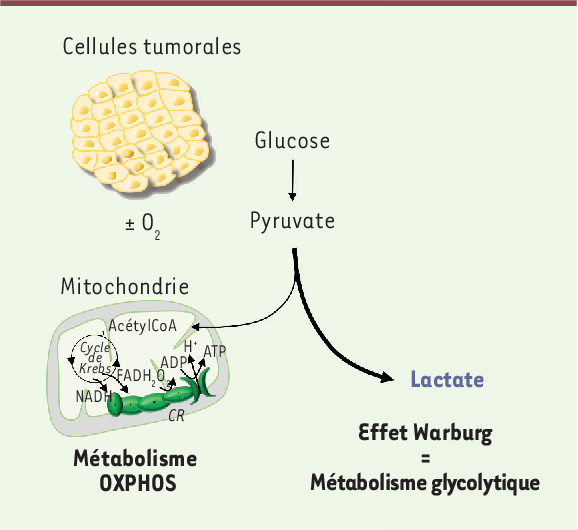
Le métabolisme glycolytique aérobie des cellules cancéreuses connu sous le nom d’effet Warburg reflète la capacité intrinsèque d’une tumeur à modifier son métabolisme par l’augmentation significative de son absorption de glucose, permettant au cancer de proliférer de manière incontrôlable via des processus anaboliques accrus produisant le carbone nécessaire à la prolifération. En plus des changements intrinsèques, les interactions de la tumeur avec son microenvironnement ont également un impact sur le métabolisme du cancer. Le microenvironnement fournit des métabolites comme cela a été montré avec les fibroblastes associés au cancer qui sécrètent du lactate, du pyruvate, des corps cétoniques, du glycogène et des cytokines et peuvent transférer les mitochondries aux cellules cancéreuses améliorant la fonction mitochondriale des cellules cancéreuses, l’activité du cycle de l’acide tricarboxylique (TCA), phosphorylation oxydative (OXPHOS) ainsi que la glycolyse qui, associées au remodelage de la matrice extracellulaire entraînent une capacité métastatique accrue. De même, dans le cancer de l’ovaire, les lipides sont transférés des adipocytes aux cellules tumorales, favorisant l’OXPHOS.
L’analyse de 20 ans de données de suivi sur une cohorte humaine prospective ( n= 2 734 ; 1 302 femmes et 1 432 hommes) ont révélé que l’exercice de haute intensité réduit considérablement le risque de cancer métastatique.
Parce que l’exercice a été pratiqué avant l’apparition du cancer, l’exercice modifie les capacités métaboliques des organes hôtes, les protégeant ainsi contre la dissémination du cancer.
La diaphonie cancer-stroma induite par l’exercice influence directement le microenvironnement tumoral modifiant ainsi les capacités métaboliques des cellules tumorales métastatiques. L’exercice reprogramme le microenvironnement tumoral via le développement d’un bouclier métabolique stromal qui protège le stroma de la colonisation métastatique en défiant les demandes métaboliques des cancers.
Compte tenu de la plasticité métabolique observée au cours de la progression du cancer et des altérations métaboliques dans les organes hôtes après l’exercice, les auteurs supposent que ces deux programmes métaboliques s’opposent. Ils émettent donc l’hypothèse que la reprogrammation métabolique des organes induite par l’exercice les transforme en microenvironnements métaboliques résistants aux métastases en limitant la disponibilité des nutriments pour les cellules cancéreuses, créant ainsi un bouclier métabolique.
Discussion
1. Activité physique-progression du cancer-métastases
Le développement de métastases découle d’interactions avec le microenvironnement (cellules stromales, nutriments et oxygène. Il est donc clair que l’état métabolique des cellules cancéreuses joue un rôle central à la fois dans la sélection et l’adaptation au cours de la progression du cancer.
Les caractéristiques classiques du cancer y compris la réponse immunitaire, la vascularisation tumorale, l’hypoxie, le pH et l’autophagie peuvent toutes être affectées par l’exercice physique contribuant ainsi à créer davantage un microenvironnement tumoral hostile contre la tumeur. La consommation de glucose par les cellules cancéreuses restreint métaboliquement l’activité des lymphocytes T dans le microenvironnement tumoral provoquant une perte de fonction des lymphocytes T. Cela soutient l’hypothèse selon laquelle l’activité physique peut induire des capacités métaboliques des cellules immunitaires dans le microenvironnement tumoral, améliorant ainsi la réponse immunitaire au cancer. Les études futures devraient étudier la relation entre les changements métaboliques et l’efficacité du système immunitaire.
2. Facteurs musculaires pouvant contrôler la dynamique du cancer
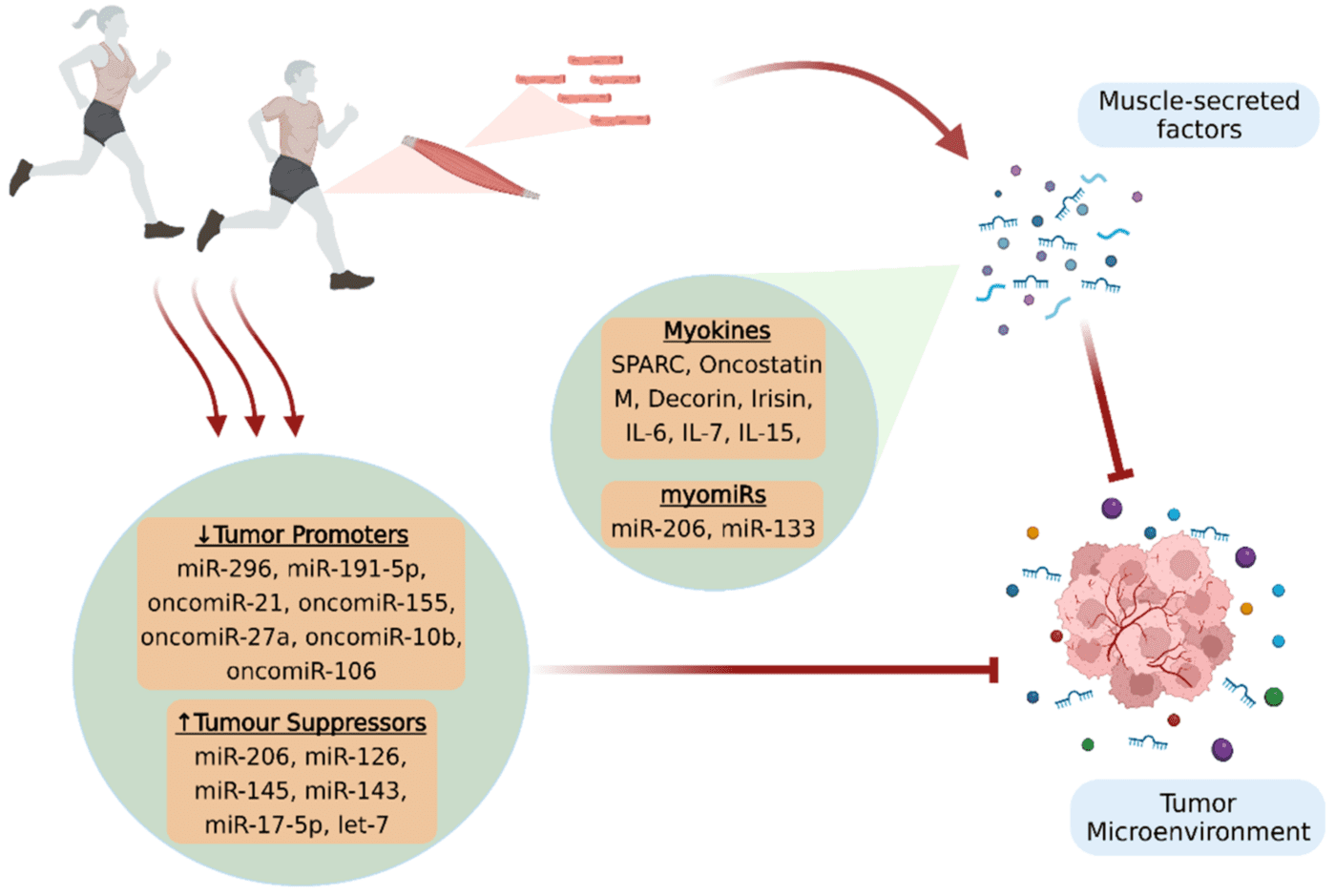
Les facteurs d’origine musculaire, les myokines et les miARN sécrétés en réponse à la contraction semblent médier les effets bénéfiques induits par l’exercice et être responsables des communications inter-tissulaires qui peuvent contrôler la dynamique du cancer. Dans le transport intercellulaire et la livraison des biomolécules sécrétées par les muscles, les exosomes jouent un rôle important, délivrant leur contenu (miARN et myokines) dans les cellules cibles. Le sécrétome musculaire peut moduler l’évolution du cancer directement en agissant sur les cellules cancéreuses et indirectement en stimulant la réponse immunitaire et en compensant la sarcopénie liée au cancer, qui affecte la qualité de vie des patients.
3. Le métabolisme du glycogène
 Le métabolisme du glycogène est régulé à la hausse dans de nombreux types de tumeurs ce qui suggère qu’il s’agit d’un aspect important de la physiopathologie des cellules cancéreuses. Étant donné que les cellules musculaires ont besoin d’une grande quantité de glycogène après des périodes d’exercice prolongé ou de haute intensité pour revenir aux concentrations de glycogène d’avant l’exercice, les muscles peuvent prendre jusqu’à 24 heures pour remplacer les réserves de glycogène. Ce phénomène connu sous le nom de super-compensation pourrait protéger les muscles de la dissémination métastatique car les cellules musculaires entrent en compétition avec les cellules malignes pour les ressources en glycogène disponibles. De plus, le processus de super-compensation pourrait également fournir un bouclier métabolique contre l’ensemencement de tumeurs dans les organes internes. Une manière supplémentaire de générer une compétition entre les cellules normales et cancéreuses consiste à diminuer les ressources en glucose disponibles. Par exemple, des régimes à faible teneur en glucides tels que le régime cétogène ont été proposés pour affamer la croissance maligne en inhibant la disponibilité du stockage du glycogène. Plusieurs études à long terme avec de grandes cohortes humaines et des études utilisant des modèles animaux ont montré une corrélation entre le risque de cancer et la composition alimentaire. Plusieurs facteurs liés à la nutrition sont associés à l’incidence du cancer. Par exemple, la suralimentation conduit à l’obésité qui est associée à une altération du métabolisme de tout le corps y compris une diminution de la capacité à éliminer et à stocker rapidement les calories excédentaires. Des niveaux élevés d’expression du récepteur tumoral de la progestérone observés chez les humains obèses et les animaux suralimentés sont associés à un phénotype glycolytique-lipogénique typique des tumeurs agressives et à des taux métastatiques élevés. De plus, les régimes riches en graisses et la consommation de grandes quantités d’acides gras saturés augmentent la perméabilité intestinale et induisent une inflammation du côlon et une inflammation des graisses mésentériques qui augmentent le risque global de cancer. D’autres facteurs corrélés au risque de cancer sont la consommation d’alcool qui est nocive et l’apport en fibres qui améliore l’immunosurveillance du cancer.
Le métabolisme du glycogène est régulé à la hausse dans de nombreux types de tumeurs ce qui suggère qu’il s’agit d’un aspect important de la physiopathologie des cellules cancéreuses. Étant donné que les cellules musculaires ont besoin d’une grande quantité de glycogène après des périodes d’exercice prolongé ou de haute intensité pour revenir aux concentrations de glycogène d’avant l’exercice, les muscles peuvent prendre jusqu’à 24 heures pour remplacer les réserves de glycogène. Ce phénomène connu sous le nom de super-compensation pourrait protéger les muscles de la dissémination métastatique car les cellules musculaires entrent en compétition avec les cellules malignes pour les ressources en glycogène disponibles. De plus, le processus de super-compensation pourrait également fournir un bouclier métabolique contre l’ensemencement de tumeurs dans les organes internes. Une manière supplémentaire de générer une compétition entre les cellules normales et cancéreuses consiste à diminuer les ressources en glucose disponibles. Par exemple, des régimes à faible teneur en glucides tels que le régime cétogène ont été proposés pour affamer la croissance maligne en inhibant la disponibilité du stockage du glycogène. Plusieurs études à long terme avec de grandes cohortes humaines et des études utilisant des modèles animaux ont montré une corrélation entre le risque de cancer et la composition alimentaire. Plusieurs facteurs liés à la nutrition sont associés à l’incidence du cancer. Par exemple, la suralimentation conduit à l’obésité qui est associée à une altération du métabolisme de tout le corps y compris une diminution de la capacité à éliminer et à stocker rapidement les calories excédentaires. Des niveaux élevés d’expression du récepteur tumoral de la progestérone observés chez les humains obèses et les animaux suralimentés sont associés à un phénotype glycolytique-lipogénique typique des tumeurs agressives et à des taux métastatiques élevés. De plus, les régimes riches en graisses et la consommation de grandes quantités d’acides gras saturés augmentent la perméabilité intestinale et induisent une inflammation du côlon et une inflammation des graisses mésentériques qui augmentent le risque global de cancer. D’autres facteurs corrélés au risque de cancer sont la consommation d’alcool qui est nocive et l’apport en fibres qui améliore l’immunosurveillance du cancer.
Conclusion
Les avantages de l’exercice physique contre l’apparition et la progression du cancer ainsi que les effets néfastes de l’inactivité physique ont changé la façon dont nous utilisons l’exercice pour les patients atteints de cancer. Néanmoins, les mécanismes cellulaires et moléculaires exacts par lesquels l’exercice agit contre le cancer n’ont pas encore été élucidés.
Les facteurs d’origine musculaire, les myokines et les miARN sécrétés en réponse à la contraction semblent médier les effets bénéfiques induits par l’exercice et être responsables des communications inter-tissulaires qui peuvent contrôler la dynamique du cancer.
La reprogrammation métabolique des organes induite par l’exercice les transforme en microenvironnements métaboliques résistants aux métastases en limitant la disponibilité des nutriments pour les cellules cancéreuses, créant ainsi un bouclier métabolique.
Bibliographie
- An Exercise-Induced Metabolic Shield in Distant Organs Blocks Cancer Progression and Metastatic Dissemination. Danna Sheinboim, Carmit Levy and All. Cancer Res (2022) 82 (22): 4164–4178. https://doi.org/10.1158/0008-5472.CAN-22-0237
-
Physical Exercise Restrains Cancer Progression through Muscle-Derived Factors. Mrs. Argyro Papadopetraki, Maria Maridaki, Prof. Flora Zagouri, Prof. Meletios-Athanasios Dimopoulos, Prof. Dr. Michael Koutsilieris, Prof. Anastassios Philippou. Cancers 2022, 14(8), 1892; https://doi.org/10.3390/cancers14081892
 Cliquez sur l’image pour visionner la vidéo
Cliquez sur l’image pour visionner la vidéo