 Le terme fibromyalgie vient de « fibro », pour fibrose, de « myo » qui signifie muscles et d’« algie » qui signifie douleur.
Le terme fibromyalgie vient de « fibro », pour fibrose, de « myo » qui signifie muscles et d’« algie » qui signifie douleur.
La fibromyalgie est un syndrome caractérisé par des douleurs diffuses dans tout le corps, souvent associées à une grande fatigue et à des troubles du sommeil.
C’est une maladie qui n’entraîne pas de complications graves, mais qui est très éprouvante et empêche souvent la personne qui en souffre d’accomplir ses activités quotidiennes.
Prévalence (1)
Les statistiques révèlent que, dans les pays industrialisés, la fibromyalgie touche de 2 % à 6 % de la population.
Environ 80 % des personnes atteintes sont des femmes. La maladie apparaît souvent vers 30 ans à 60 ans. Quelques rares cas de fibromyalgie ont toutefois été décrits chez des enfants, sans que l’on soit certain qu’il s’agisse de la même maladie.
Symptômes (1)
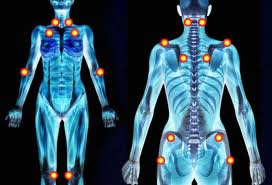 La fibromyalgie est caractérisée par des douleurs étendues et diffuses, principalement musculaires, associées à une fatigue chronique et des troubles du sommeil. Cependant, les symptômes diffèrent d’une personne à l’autre. De plus, le climat, le moment de la journée, le niveau de stress et d’activité physique sont des facteurs qui influencent la gravité des symptômes et leur variabilité dans le temps.
La fibromyalgie est caractérisée par des douleurs étendues et diffuses, principalement musculaires, associées à une fatigue chronique et des troubles du sommeil. Cependant, les symptômes diffèrent d’une personne à l’autre. De plus, le climat, le moment de la journée, le niveau de stress et d’activité physique sont des facteurs qui influencent la gravité des symptômes et leur variabilité dans le temps.
Voici les principaux symptômes.
• Des douleurs musculaires diffuses qui s’accompagnent de raideurs matinales, et de certains endroits précis du corps douloureux au toucher (voir le schéma). Le cou et les épaules sont généralement les premiers endroits douloureux, suivis par le dos, le thorax, les bras et les jambes.
• Dans les situations extrêmes, un simple toucher ou même un effleurement cause des douleurs sur tout le corps (un phénomène nommé allodynie). La douleur peut s’accompagner de l’impression que les zones douloureuses sont gonflées.
• Une douleur constante, mais aggravée par les efforts, le froid, l’humidité, les émotions et le manque de sommeil.
• Un sommeil léger et non réparateur, causant une fatigue dès le réveil.
• Une fatigue persistante (toute la journée), présente dans 9 cas sur 10. Le repos ne permet pas de la faire disparaître.
• Des maux de tête ou de fortes migraines, possiblement causés par des tensions musculaires au cou et aux épaules, et par un dérèglement des voies naturelles de contrôle de la douleur.
• Un syndrome de l’intestin irritable : diarrhée, constipation et douleurs abdominales.
• Un état dépressif ou une anxiété (chez environ le tiers des personnes fibromyalgiques).
• Des difficultés de concentration.
• Une augmentation de l’acuité des sens, soit une sensibilité accrue aux odeurs, à la lumière, au bruit et aux changements de température (en plus de la sensibilité au toucher).
• Un engourdissement et des fourmillements aux mains et aux pieds.
• Des menstruations douloureuses et un syndrome prémenstruel marqué.
• Un syndrome de la vessie irritable (cystite interstitielle).
Causes
L’expression de nos gènes
 La régulation de l’expression de nos gènes peut dépendre de facteurs extérieurs dits épigénétiques. L’épigénétisme régule l’activité des gènes en facilitant ou en empêchant leur expression. Elle est fondamentale car elle permet une lecture différente d’un même code génétique. Elle explique par exemple les différences existant chez des vrais jumeaux et peut donc expliquer également l’apparition des maladies auto-immunes et de la fibromyalgie (2, 3, 4, 5, 6, 7, 50, 54)
La régulation de l’expression de nos gènes peut dépendre de facteurs extérieurs dits épigénétiques. L’épigénétisme régule l’activité des gènes en facilitant ou en empêchant leur expression. Elle est fondamentale car elle permet une lecture différente d’un même code génétique. Elle explique par exemple les différences existant chez des vrais jumeaux et peut donc expliquer également l’apparition des maladies auto-immunes et de la fibromyalgie (2, 3, 4, 5, 6, 7, 50, 54)
La flore intestinale
 La microflore intestinale est une communauté complexe de micro-organismes qui colonise le tractus gastro-intestinal. La composition de la flore intestinale et le nombre de micro-organismes dépendent des conditions environnementales locales. Le micro-biotope intestinal a un impact important sur le développement de l’architecture et de la fonction intestinale, elle influence le développement du système immunitaire associé à l’intestin, et les fonctions des cellules épithéliales. Une des fonctions les plus importantes de la microflore intestinale « amie » est la prévention de la prolifération bactérienne pouvant générer in statut inflammatoire et être à l’origine de nombreuses « maladies dites de civilisation ». En outre, le microbiotope intestinale joue un rôle crucial dans le développement de l’immunité et a une influence importante sur la nutrition et le métabolisme de l’hôte. Cependant, chez les individus génétiquement prédisposés, le microbiotope intestinal est impliqué dans la physiopathologie de nombreuses maladies inflammatoires (8,9, 10, 11).
La microflore intestinale est une communauté complexe de micro-organismes qui colonise le tractus gastro-intestinal. La composition de la flore intestinale et le nombre de micro-organismes dépendent des conditions environnementales locales. Le micro-biotope intestinal a un impact important sur le développement de l’architecture et de la fonction intestinale, elle influence le développement du système immunitaire associé à l’intestin, et les fonctions des cellules épithéliales. Une des fonctions les plus importantes de la microflore intestinale « amie » est la prévention de la prolifération bactérienne pouvant générer in statut inflammatoire et être à l’origine de nombreuses « maladies dites de civilisation ». En outre, le microbiotope intestinale joue un rôle crucial dans le développement de l’immunité et a une influence importante sur la nutrition et le métabolisme de l’hôte. Cependant, chez les individus génétiquement prédisposés, le microbiotope intestinal est impliqué dans la physiopathologie de nombreuses maladies inflammatoires (8,9, 10, 11).
Le syndrome de l’intestin perméable
 Le syndrome d’intestin perméable est un des facteurs pouvant expliquer l’apparition de la fibromyalgie il est fréquemment associé à pullulation de germes pathogènes appelée dysbiose responsable de douleurs digestives et de troubles du transit. Ce déséquilibre en faveur d’une flore pathogène est directement corrélé à l’intensité de la douleur (12, 13, 14, 51, 52)
Le syndrome d’intestin perméable est un des facteurs pouvant expliquer l’apparition de la fibromyalgie il est fréquemment associé à pullulation de germes pathogènes appelée dysbiose responsable de douleurs digestives et de troubles du transit. Ce déséquilibre en faveur d’une flore pathogène est directement corrélé à l’intensité de la douleur (12, 13, 14, 51, 52)
Ce syndrome de l’intestin perméable est responsable d’une stimulation anormale de notre système immunitaire (80% de nos défenses immunitaires sont situées dans notre tube digestif) engendrant la synthèse de composés pro-inflammatoires.
La restauration d’une barrière digestive fonctionnelle est l’une des étapes de la guérison (15, 16).
Mitochondrie et stress oxydant
 La fibromyalgie est une forme de rhumatisme (inflammation) non articulaire caractérisée par des douleurs musculo-squelettiques généralisée chronique.
La fibromyalgie est une forme de rhumatisme (inflammation) non articulaire caractérisée par des douleurs musculo-squelettiques généralisée chronique.
La dysfonction mitochondriale engendre un excès de stress oxydatif (17, 18, 19) et une diminution de la synthèse d’ATP, l’énergie universelle de nos cellules expliquant l’un des symptômes rencontré : la fatigue.
L’excès de stress oxydant est fréquemment rencontré dans la fibromyalgie (20, 21, 22, 23, 24), la correction de ce déséquilibre fait partie intégrante de la prise en charge thérapeutique (25, 26).
La sérotonine neurotransmetteur de la « zen attitude »
 Le tryptophane est un acide aminé essentiel qui peut être métabolisé en sérotonine, neurotransmetteur de « la zen attitude » mais en cas d’inflammation la biodisponibilité du tryptophane pour la synthèse de la sérotonine se trouve très fortement réduite car il est métabolisé en substances jouant un rôle clef dans la modulation de la réponse immunitaire : les kinurenines.
Le tryptophane est un acide aminé essentiel qui peut être métabolisé en sérotonine, neurotransmetteur de « la zen attitude » mais en cas d’inflammation la biodisponibilité du tryptophane pour la synthèse de la sérotonine se trouve très fortement réduite car il est métabolisé en substances jouant un rôle clef dans la modulation de la réponse immunitaire : les kinurenines.
La voie de la kynurénine a été démontrée être impliqué dans de nombreuses maladies telles que la maladie d’Alzheimer, la sclérose latérale amyotrophique, la maladie de Huntington, le syndrome de démence du sida, la malaria, le cancer, la dépression et la schizophrénie (47, 48).
Déficiences hormonales associées
L’hormone de croissance
 Bien que la douleur ne fasse pas partie des signes cliniques du syndrome de déficience en hormone de croissance, beaucoup de manifestations cliniques sont similaires. De nombreuses études ont mis en évidence une diminution de sécrétion d’hormone de croissance chez certains patients souffrant de fibromyalgie. La prise d’hormone de croissance chez ces patients améliore considérablement certains symptômes de la fibromyalgie ainsi que leur qualité de vie, suggérant un lien de causalité direct entre fibromyalgie et carence en hormone de croissance. Malgré l’utilisation de doses relativement élevées d’hormone de croissance chez ces patients, le traitement semble être bien toléré. Plusieurs mécanismes d’action ont été proposées, y compris à la fois la modulation centrale de la douleur et les effets musculo-tendineuse périphériques, comme déjà décrit dans le syndrome de déficience en hormone de croissance(27, 28, 29, 49).
Bien que la douleur ne fasse pas partie des signes cliniques du syndrome de déficience en hormone de croissance, beaucoup de manifestations cliniques sont similaires. De nombreuses études ont mis en évidence une diminution de sécrétion d’hormone de croissance chez certains patients souffrant de fibromyalgie. La prise d’hormone de croissance chez ces patients améliore considérablement certains symptômes de la fibromyalgie ainsi que leur qualité de vie, suggérant un lien de causalité direct entre fibromyalgie et carence en hormone de croissance. Malgré l’utilisation de doses relativement élevées d’hormone de croissance chez ces patients, le traitement semble être bien toléré. Plusieurs mécanismes d’action ont été proposées, y compris à la fois la modulation centrale de la douleur et les effets musculo-tendineuse périphériques, comme déjà décrit dans le syndrome de déficience en hormone de croissance(27, 28, 29, 49).
Le cortisol
De nombreuses études ont démontré que le rythme circadien de la sécrétion du cortisol est perturbé chez les patients souffrant de fibromyalgie. Cette augmentation anormale du taux de cortisol sérique pendant la nuit peut être l’une des causes d’un symptôme fréquemment rencontré à savoir, un sommeil non réparateur (30).
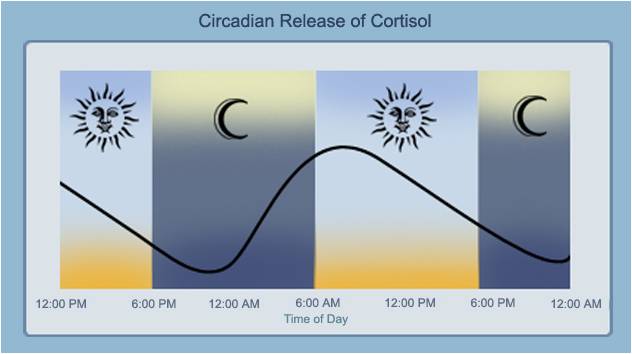
Le dysfonctionnement de l‘axe hypothalamo-hypophyso-surrénalien explique pourquoi les valeurs de cortisol au réveil sont généralement plus faibles (31) et des taux bas de cortisol peuventt être à l’origine des raideurs matinales ainsi que des douleurs.
L’inflammation rencontrée dans la fibromyalgie perturbe le fonctionnement des récepteurs à la cortisone ce qui diminue son efficacité sur des symptômes tels que la raideur et les douleurs (32)
La mélatonine
 La mélatonine peut améliorer la qualité du sommeil et augmenter le seuil à la douleur (33), elle permet de diminuer l’inflammation (34) chez les patients souffrant de fibromyalgie.
La mélatonine peut améliorer la qualité du sommeil et augmenter le seuil à la douleur (33), elle permet de diminuer l’inflammation (34) chez les patients souffrant de fibromyalgie.
Les métabolites urinaires de la mélatonine sont significativement plus bas (35), ce qui peut avoir un impact direct et négatif sur les signes cliniques qui composent le tableau de la fibromyalgie.
La perception de la douleur est plus marquée le jour, les taux de mélatonines élevés durant la nuit produisent un effet analgésique.
Les taux de mélatonine étant significativement plus bas chez les patients fibromyalgiques, un traitement par mélatonine améliore la douleur, la fatigue, le sommeil, la raideur matinale ainsi que la dépression (35, 36, 37).
La mélatonine a également été jugé utile dans le traitement du syndrome du côlon irritable (38) pathologie fréquemment associée à la fibromyalgie.
Le traitement à la mélatonine a plusieurs effets positifs sur les patients atteints de FM, notamment l’amélioration de la qualité du sommeil, la douleur et l’impact de la maladie. Contrairement aux agents pharmacologiques conventionnels, aucun événement indésirable majeur n’a été signalé suite à la consommation de mélatonine.(53)
L’ocytocine
 L’ocytocine réduit la sévérité de la douleur, l’anxiété et la dépression et améliore la qualité du sommeil, ce qui suggère que l’ocytocine peut être utile pour traiter la fibromyalgie (39).
L’ocytocine réduit la sévérité de la douleur, l’anxiété et la dépression et améliore la qualité du sommeil, ce qui suggère que l’ocytocine peut être utile pour traiter la fibromyalgie (39).
Des taux bas d’ocytocine sont retrouvés dans la dépression, en cas de douleur importante, le stress.
L’ocytocine est connue pour avoir des effets anti-nociceptifs et analgésiques ainsi qu’anxiolytiques et antidépresseurs, ce qui rend ce neuropeptide d‘un grand intérêt thérapeutique pour les patients souffrant de fibromyalgie (40, 41).
La vitamine D
 Le terme de vitamine D est inapproprié puisqu’il s’agit bien plus d’une hormone que d’une vitamine.
Le terme de vitamine D est inapproprié puisqu’il s’agit bien plus d’une hormone que d’une vitamine.
De nombreuses études ont établi un lien entre des taux faibles de 25-hydroxyvitamine D et les douleurs musculo-squelettiques comme rencontrées dans le syndrome de la fibromyalgie (42, 43, 44, 45)
La prescription de fortes doses de vitamine D permet de corriger cette carence et pourrait conduire à la résolution de presque tous les symptômes (46).
Bibliographie
1. http://www.passeportsante.net/fr/Maux/Problemes/Fiche.aspx?doc=fibromyalgie_pm
2. Interplays between gut microbiota and gene expression regulation by miRNAs.Andrea Masotti. Front Cell Infect Microbiol. 2012; 2: 137.
3. Nat Rev Microbiol. 2013 Apr;11(4):227-38. doi: 10.1038/nrmicro2974. Epub 2013 Feb 25. The gut microbiota–masters of host development and physiology. Sommer F1, Bäckhed F.
4. Beyond pain in fibromyalgia: insights into the symptom of fatigue. Ann Vincent,corresponding , Roberto P Benzo, Mary O Whipple, Samantha J McAllister, Patricia J Erwin, and Leorey N Saligan. Arthritis Res Ther. 2013; 15(6): 221. Published online Nov 29, 2013.
5. Gene expression alterations at baseline and following moderate exercise in patients with Chronic Fatigue Syndrome, and Fibromyalgia Syndrome. A.R. Light, and Coll. J Intern Med. Author manuscript; available in PMC 2013 January 1.
6. The Fibromyalgia Family Study: A Genome-Scan Linkage Study. Lesley M. Arnold, Jinbo Fan, I. Jon Russell, Muhammad B. Yunus, Muhammad Asim Khan, Irving Kushner, Jane M. Olson, posthumous, Sudha K. Iyengar. Arthritis Rheum. Author manuscript; available in PMC 2014 April 1.
7. Gene expression profiles of fatigued fibromyalgia patients with different categories of pain and catastrophizing: A preliminary report. Nada Lukkahatai, Benjamin Majors, Swarnalatha Reddy, Brian Walitt, Leorey N. Saligan. Nurs Outlook. Author manuscript; available in PMC 2014 July 1. Published in final edited form as: Nurs Outlook. 2013 Jul-Aug; 61(4): 216–224.e2.
8. Hypothesis: Bacteria Control Host Appetites. Vic Norris, Franck Molina, and Andrew T. Gewirtz. J Bacteriol. Feb 2013; 195(3): 411–416.
9. The gut microflora and its variety of roles in health and disease. Frick JS1, Autenrieth IB. Curr Top Microbiol Immunol. 2013;358:273-89.
10. Innate lymphoid cell interactions with microbiota: implications for intestinal health and disease. Sonnenberg GF1, Artis D. Immunity. 2012 Oct 19;37(4):601-10.
11. Alterations in intestinal microbial flora and human disease. Othman M1, Agüero R, Lin HC. Curr Opin Gastroenterol. 2008 Jan;24(1):11-6.
12. Fibromyalgia and non-celiac gluten sensitivity: a description with remission of fibromyalgia. Isasi C, Colmenero I, Casco F, Tejerina E, Fernandez N, Serrano-Vela JI, Castro MJ, Villa LF. Rheumatol Int. 2014 Apr 12.
13. Remarkable prevalence of coeliac disease in patients with irritable bowel syndrome plus fibromyalgia in comparison with those with isolated irritable bowel syndrome: a case-finding study. Rodrigo L, Blanco I, Bobes J, de Serres FJ. Arthritis Res Ther. 2013;15(6):R201.
14. Alterations in intestinal microbial flora and human disease. Othman M, Agüero R, Lin HC. Curr Opin Gastroenterol. 2008 Jan;24(1):11-6.
15. Clinical impact of a gluten-free diet on health-related quality of life in seven fibromyalgia syndrome patients with associated celiac disease. Rodrigo L1, Blanco I, Bobes J, de Serres FJ. BMC Gastroenterol. 2013 Nov 9;13:157. doi: 10.1186/1471-230X-13-157.
16. Normalization of leaky gut in chronic fatigue syndrome (CFS) is accompanied by a clinical improvement: effects of age, duration of illness and the translocation of LPS from gram-negative bacteria. Maes M1, Leunis JC. Neuro Endocrinol Lett. 2008 Dec;29(6):902-10.
17. Oxidative stress and mitochondrial dysfunction in fibromyalgia. Cordero MD, de Miguel M, Carmona-López I, Bonal P, Campa F, Moreno-Fernández AM. Neuro Endocrinol Lett. 2010;31(2):169-73.
18. The role of mitochondrial dysfunctions due to oxidative and nitrosative stress in the chronic pain or chronic fatigue syndromes and fibromyalgia patients: peripheral and central mechanisms as therapeutic targets? Meeus M, Nijs J, Hermans L, Goubert D, Calders P. Expert Opin Ther Targets. 2013 Sep;17(9):1081-9.
19. Could mitochondrial dysfunction be a differentiating marker between chronic fatigue syndrome and fibromyalgia? Castro-Marrero J, Cordero MD, Sáez-Francas N, Jimenez-Gutierrez C, Aguilar-Montilla FJ, Aliste L, Alegre-Martin J. Antioxid Redox Signal. 2013 Nov 20;19(15):1855-60. doi: 10.1089/ars.2013.5346.
20. Pathophysiology and antioxidant status of patients with fibromyalgia. Iqbal R, Mughal MS, Arshad N, Arshad M.
21. Is fibromyalgia-related oxidative stress implicated in the decline of physical and mental health status? La Rubia M, Rus A, Molina F, Del Moral ML.
22. Evaluation of some antioxidant enzyme activities (SOD and GPX) and their polymorphisms (MnSOD2 Ala9Val, GPX1 Pro198Leu) in fibromyalgia. Akbas A, Inanir A, Benli I, Onder Y, Aydogan L. Eur Rev Med Pharmacol Sci. 2014;18(8):1199-203.
23. Oxidative stress and antioxidative parameters and metal ion content in patients with fibromyalgia syndrome: implications in the pathogenesis of the disease. Fatima G, Das SK, Mahdi AA. Clin Exp Rheumatol. 2013 Nov-Dec;31. Suppl 79:S128-33.
24. Is fibromyalgia-related oxidative stress implicated in the decline of physical and mental health status? La Rubia M, Rus A, Molina F, Del Moral ML. Clin Exp Rheumatol. 2013 Nov-Dec;31(6 Suppl 79):S121-7.
25. Is inflammation a mitochondrial dysfunction-dependent event in fibromyalgia? Cordero MD, Díaz-Parrado E, Carrión AM, Alfonsi S, Sánchez-Alcazar JA, Bullón P, Battino M, de Miguel M. Antioxid Redox Signal. 2013 Mar 1;18(7):800-7. doi: 10.1089/ars.2012.4892.
26. Oral coenzyme Q10 supplementation improves clinical symptoms and recovers pathologic alterations in blood mononuclear cells in a fibromyalgia patient. Cordero MD, Cotán D, del-Pozo-Martín Y, Carrión AM, de Miguel M, Bullón P, Sánchez-Alcazar JA. Nutrition. 2012 Nov-Dec;28(11-12):1200-3. doi: 10.1016/j.nut.2012.03.018.
27. GH/IGF1 axis disturbances in the fibromyalgia syndrome: is there a rationale for GH treatment? Cuatrecasas G1, Alegre C, Casanueva FF. Pituitary. 2014 Jun;17(3):277-83.
28. Fibromyalgic syndromes: could growth hormone therapy be beneficial? Cuatrecasas G. Pediatr Endocrinol Rev. 2009 Jun;6 Suppl 4:529-33.
29. Growth hormone treatment for sustained pain reduction and improvement in quality of life in severe fibromyalgia. Cuatrecasas G, Alegre C, Fernandez-Solà J, Gonzalez MJ, Garcia-Fructuoso F, Poca-Dias V, Nadal A, Cuatrecasas G, Navarro F, Mera A, Lage M, Peinó R, Casanueva F, Liñan C, Sesmilo G, Coves MJ, Izquierdo JP, Alvarez I, Granados E, Puig-Domingo M. Pain. 2012 Jul;153(7):1382-9. doi: 10.1016/j.pain.2012.02.012.
30. Circadian rhythm of serum cortisol in female patients with fibromyalgia syndrome. Fatima G1, Das SK, Mahdi AA, Verma NS, Khan FH, Tiwari AM, Jafer T, Anjum B. Indian J Clin Biochem. 2013 Apr;28(2):181-4. doi: 10.1007/s12291-012-0258-z. Epub 2012 Sep 27.
31. Fibromyalgia syndrome is associated with hypocortisolism. Riva R1, Mork PJ, Westgaard RH, Rø M, Lundberg U. Int J Behav Med. 2010 Sep;17(3):223-33.
32. Evidence for an association between an enhanced reactivity of interleukin-6 levels and reduced glucocorticoid sensitivity in patients with fibromyalgia. Geiss A, Rohleder N, Anton F. Psychoneuroendocrinology. 2012 May;37(5):671-84.
33. Melatonin analgesia is associated with improvement of the descending endogenous pain-modulating system in fibromyalgia: a phase II, randomized, double-dummy, controlled trial. de Zanette SA, Vercelino R, Laste G, Rozisky JR, Schwertner A, Machado CB, Xavier F, de Souza IC, Deitos A, Torres IL, Caumo W. BMC Pharmacol Toxicol. 2014 Jul 23;15(1):40.
34. Local melatonin regulates inflammation resolution: a common factor in neurodegenerative, psychiatric and systemic inflammatory disorders. Anderson G, Maes M. CNS Neurol Disord Drug Targets. 2014;13(5):817-27.
35. The involvement of melatonin in the clinical status of patients with fibromyalgia syndrome. Pernambuco AP, Schetino LP, Viana RS, Carvalho LS, d’Ávila Reis D. Clin Exp Rheumatol. 2014 Feb 24.
36. Melatonin in Antinociception: Its Therapeutic Applications. Venkatramanujam Srinivasan, Edward C Lauterbach, Khek Yu Ho, Dario Acuña-Castroviejo, Rahimah Zakaria, and Amnon Brzezinski. Curr Neuropharmacol. Jun 2012; 10(2): 167–178.
37. Adjuvant use of melatonin for treatment of fibromyalgia. Hussain SA, Al-Khalifa II, Jasim NA, Gorial FI. J Pineal Res. 2011 Apr;50(3):267-71.
38. Analgesic effects of melatonin: a review of current evidence from experimental and clinical studies. Wilhelmsen M, Amirian I, Reiter RJ, Rosenberg J, Gögenur I. J Pineal Res. 2011 Oct;51(3):270-7.
39. Oxytocin nasal spray in fibromyalgic patients. Mameli S, Pisanu GM, Sardo S, Marchi A, Pili A, Carboni M, Minerba L, Trincas G, Carta MG, Melis MR, Agabio R. Rheumatol Int. 2014 Aug;34(8):1047-52.
40. Plasma oxytocin levels in female fibromyalgia syndrome patients. Anderberg UM, Uvnäs-Moberg K. Z Rheumatol. 2000 Dec;59(6):373-9.
41. The effect of intranasal oxytocin administration on acute cold pressor pain: a placebo-controlled, double-blind, within-participants crossover investigation. Rash JA, Campbell TS. Psychosom Med. 2014 Jul-Aug;76(6):422-9.
42. The relation between vitamin D deficiency and fibromyalgia syndrome in women. Matthana MH. Saudi Med J. 2011 Sep;32(9):925-9.
43. Is vitamin D deficiency associated with non specific musculoskeletal pain? Abbasi M, Hashemipour S, Hajmanuchehri F, Kazemifar AM. Glob J Health Sci. 2012 Nov 11;5(1):107-11.
44. Vitamin D supplementation for nonspecific musculoskeletal pain in non-Western immigrants: a randomized controlled trial. Schreuder F, Bernsen RM, van der Wouden JC. Ann Fam Med. 2012 Nov-Dec;10(6):547-55.
45. Musculoskeletal chronic pains and Vitamin D deficiency. Study before after in general practice. [Article in French]. Le Goaziou MF, Bodier E, Souweine G, Moreau A, Perdrix C, Flori M, Dupraz C. Presse Med. 2013 Apr;42(4 Pt 1):e106-13.
46. Vitamin D deficiency in women with fibromyalgia in Saudi Arabia. Abokrysha NT. Pain Med. 2012 Mar;13(3):452-8.
47 Kynurenine pathway metabolites in humans: disease and healthy States. Chen Y, Guillemin GJ. Int J Tryptophan Res. 2009;2:1-19.
48 Kynurenine Pathway Pathologies: do Nicotinamide and Other Pathway Co-Factors have a Therapeutic Role in Reduction of Symptom Severity, Including Chronic Fatigue Syndrome (CFS) and Fibromyalgia (FM). Int J Tryptophan Res. 2013 Jul 21;6(Suppl 1):39-45.
49 Growth hormone as concomitant trement in severe fibromyalgia associated with low IGF-1 serum levels. A pilot study. Guillem Cuatrecasas, cristina Riudavets, Maria Antonia Güell and Albert Nadal. BMC Musculoskelet Disord. 2007; 8: 119.
50. Fibromyalgia: Genetics and epigenetics insights may provide the basis for the development of diagnostic biomarkers. Simona D’Agnelli, Lars Arendt-Nielsen, Maria C Gerra, Katia Zatorri, Lorenzo Boggiani, Marco Baciarello, and Elena Bignami. Mol Pain. 2019; 15: 1744806918819944.
51 Determining the association betweenfibromyalgia, the gut microbiome and itsbiomarkers: A systematic review. Sharon Erdrich, Jason A. Hawrelak, Stephen P. Myers, and Joanna E. Harnett. BMC Musculoskelet Disord. 2020; 21: 181.
52 Gut microbiome and serum metabolome analyses identify molecular biomarkers and altered glutamate metabolism in fibromyalgia. Marc Clos-Garcia,Naiara Andrés-Marin, Gorka Fernández-Eulate Leticia Abecia, José L. Lavín, Sebastiaan van Liempd, Diana Cabrera, Félix Royo, Alejandro Valero, Nerea Errazquin, María Cristina Gómez Vega, Leila Govillard, Michael R. Tackett, GenesisTejada,l Esperanza Gónzalez, Juan Anguita, Luis Bujanda, Ana María Callejo Orcasitas,j Ana M. Aransay,n Olga Maíz,hAdolfo López de Munain, and Juan Manuel Falcón-Pérez. EBioMedicine. 2019 Aug; 46: 499–511.
53 Melatonin in the treatment of fibromyalgiasymptoms: A systematic review. Karim Hemati, Azade Amini Kadijani, Fatemeh Sayehmiri, Saeed Mehrzadi, Mozhdeh Zabihiyeganeh, Azam Hosseinzadeh, Alireza Mirzaei. Complementary Therapies in Clinical Practice Volume 38, February 2020, 101072
54 Fibromyalgia: Genetics and epigenetics insights may provide the basis for the development of diagnostic biomarkers. Simona D’Agnelli, Lars Arendt-Nielsen, Maria C Gerra, Katia Zatorri, Lorenzo Boggiani, Marco Baciarello, ElenaBignami. Mol. Pain. 2019; 15: 1744806918819944
 Le terme fibromyalgie vient de « fibro », pour fibrose, de « myo » qui signifie muscles et d’« algie » qui signifie douleur.
Le terme fibromyalgie vient de « fibro », pour fibrose, de « myo » qui signifie muscles et d’« algie » qui signifie douleur. La fibromyalgie est caractérisée par des douleurs étendues et diffuses, principalement musculaires, associées à une fatigue chronique et des troubles du sommeil. Cependant, les symptômes diffèrent d’une personne à l’autre. De plus, le climat, le moment de la journée, le niveau de stress et d’activité physique sont des facteurs qui influencent la gravité des symptômes et leur variabilité dans le temps.
La fibromyalgie est caractérisée par des douleurs étendues et diffuses, principalement musculaires, associées à une fatigue chronique et des troubles du sommeil. Cependant, les symptômes diffèrent d’une personne à l’autre. De plus, le climat, le moment de la journée, le niveau de stress et d’activité physique sont des facteurs qui influencent la gravité des symptômes et leur variabilité dans le temps. La régulation de l’expression de nos gènes peut dépendre de facteurs extérieurs dits épigénétiques. L’épigénétisme régule l’activité des gènes en facilitant ou en empêchant leur expression. Elle est fondamentale car elle permet une lecture différente d’un même code génétique. Elle explique par exemple les différences existant chez des vrais jumeaux et peut donc expliquer également l’apparition des maladies auto-immunes et de la fibromyalgie (2, 3, 4, 5, 6, 7, 50, 54)
La régulation de l’expression de nos gènes peut dépendre de facteurs extérieurs dits épigénétiques. L’épigénétisme régule l’activité des gènes en facilitant ou en empêchant leur expression. Elle est fondamentale car elle permet une lecture différente d’un même code génétique. Elle explique par exemple les différences existant chez des vrais jumeaux et peut donc expliquer également l’apparition des maladies auto-immunes et de la fibromyalgie (2, 3, 4, 5, 6, 7, 50, 54) La microflore intestinale est une communauté complexe de micro-organismes qui colonise le tractus gastro-intestinal. La composition de la flore intestinale et le nombre de micro-organismes dépendent des conditions environnementales locales. Le micro-biotope intestinal a un impact important sur le développement de l’architecture et de la fonction intestinale, elle influence le développement du système immunitaire associé à l’intestin, et les fonctions des cellules épithéliales. Une des fonctions les plus importantes de la microflore intestinale « amie » est la prévention de la prolifération bactérienne pouvant générer in statut inflammatoire et être à l’origine de nombreuses « maladies dites de civilisation ». En outre, le microbiotope intestinale joue un rôle crucial dans le développement de l’immunité et a une influence importante sur la nutrition et le métabolisme de l’hôte. Cependant, chez les individus génétiquement prédisposés, le microbiotope intestinal est impliqué dans la physiopathologie de nombreuses maladies inflammatoires (8,9, 10, 11).
La microflore intestinale est une communauté complexe de micro-organismes qui colonise le tractus gastro-intestinal. La composition de la flore intestinale et le nombre de micro-organismes dépendent des conditions environnementales locales. Le micro-biotope intestinal a un impact important sur le développement de l’architecture et de la fonction intestinale, elle influence le développement du système immunitaire associé à l’intestin, et les fonctions des cellules épithéliales. Une des fonctions les plus importantes de la microflore intestinale « amie » est la prévention de la prolifération bactérienne pouvant générer in statut inflammatoire et être à l’origine de nombreuses « maladies dites de civilisation ». En outre, le microbiotope intestinale joue un rôle crucial dans le développement de l’immunité et a une influence importante sur la nutrition et le métabolisme de l’hôte. Cependant, chez les individus génétiquement prédisposés, le microbiotope intestinal est impliqué dans la physiopathologie de nombreuses maladies inflammatoires (8,9, 10, 11). Le syndrome d’intestin perméable est un des facteurs pouvant expliquer l’apparition de la fibromyalgie il est fréquemment associé à pullulation de germes pathogènes appelée dysbiose responsable de douleurs digestives et de troubles du transit. Ce déséquilibre en faveur d’une flore pathogène est directement corrélé à l’intensité de la douleur (12, 13, 14, 51, 52)
Le syndrome d’intestin perméable est un des facteurs pouvant expliquer l’apparition de la fibromyalgie il est fréquemment associé à pullulation de germes pathogènes appelée dysbiose responsable de douleurs digestives et de troubles du transit. Ce déséquilibre en faveur d’une flore pathogène est directement corrélé à l’intensité de la douleur (12, 13, 14, 51, 52) La fibromyalgie est une forme de rhumatisme (inflammation) non articulaire caractérisée par des douleurs musculo-squelettiques généralisée chronique.
La fibromyalgie est une forme de rhumatisme (inflammation) non articulaire caractérisée par des douleurs musculo-squelettiques généralisée chronique. Le tryptophane est un acide aminé essentiel qui peut être métabolisé en sérotonine, neurotransmetteur de « la zen attitude » mais en cas d’inflammation la biodisponibilité du tryptophane pour la synthèse de la sérotonine se trouve très fortement réduite car il est métabolisé en substances jouant un rôle clef dans la modulation de la réponse immunitaire : les kinurenines.
Le tryptophane est un acide aminé essentiel qui peut être métabolisé en sérotonine, neurotransmetteur de « la zen attitude » mais en cas d’inflammation la biodisponibilité du tryptophane pour la synthèse de la sérotonine se trouve très fortement réduite car il est métabolisé en substances jouant un rôle clef dans la modulation de la réponse immunitaire : les kinurenines. Bien que la douleur ne fasse pas partie des signes cliniques du syndrome de déficience en hormone de croissance, beaucoup de manifestations cliniques sont similaires. De nombreuses études ont mis en évidence une diminution de sécrétion d’hormone de croissance chez certains patients souffrant de fibromyalgie. La prise d’hormone de croissance chez ces patients améliore considérablement certains symptômes de la fibromyalgie ainsi que leur qualité de vie, suggérant un lien de causalité direct entre fibromyalgie et carence en hormone de croissance. Malgré l’utilisation de doses relativement élevées d’hormone de croissance chez ces patients, le traitement semble être bien toléré. Plusieurs mécanismes d’action ont été proposées, y compris à la fois la modulation centrale de la douleur et les effets musculo-tendineuse périphériques, comme déjà décrit dans le syndrome de déficience en hormone de croissance(27, 28, 29, 49).
Bien que la douleur ne fasse pas partie des signes cliniques du syndrome de déficience en hormone de croissance, beaucoup de manifestations cliniques sont similaires. De nombreuses études ont mis en évidence une diminution de sécrétion d’hormone de croissance chez certains patients souffrant de fibromyalgie. La prise d’hormone de croissance chez ces patients améliore considérablement certains symptômes de la fibromyalgie ainsi que leur qualité de vie, suggérant un lien de causalité direct entre fibromyalgie et carence en hormone de croissance. Malgré l’utilisation de doses relativement élevées d’hormone de croissance chez ces patients, le traitement semble être bien toléré. Plusieurs mécanismes d’action ont été proposées, y compris à la fois la modulation centrale de la douleur et les effets musculo-tendineuse périphériques, comme déjà décrit dans le syndrome de déficience en hormone de croissance(27, 28, 29, 49). La mélatonine peut améliorer la qualité du sommeil et augmenter le seuil à la douleur (33), elle permet de diminuer l’inflammation (34) chez les patients souffrant de fibromyalgie.
La mélatonine peut améliorer la qualité du sommeil et augmenter le seuil à la douleur (33), elle permet de diminuer l’inflammation (34) chez les patients souffrant de fibromyalgie. L’ocytocine réduit la sévérité de la douleur, l’anxiété et la dépression et améliore la qualité du sommeil, ce qui suggère que l’ocytocine peut être utile pour traiter la fibromyalgie (39).
L’ocytocine réduit la sévérité de la douleur, l’anxiété et la dépression et améliore la qualité du sommeil, ce qui suggère que l’ocytocine peut être utile pour traiter la fibromyalgie (39). Le terme de vitamine D est inapproprié puisqu’il s’agit bien plus d’une hormone que d’une vitamine.
Le terme de vitamine D est inapproprié puisqu’il s’agit bien plus d’une hormone que d’une vitamine.




