1. Introduction
Le microbiome représente une communauté diversifiée de microbes, d’archées et de virus et leurs gènes qui représentent collectivement un génome 100 fois plus grand que le nôtre. Le génome de l’hôte et le microbiome représentent collectivement un « métagénome » partagé décrit comme notre organe microbien.
Les bactéries sont les membres prédominants du microbiome intestinal, englobant plus de 99 % des gènes dans l’intestin.
Quatre phylums principaux dominent ce microbiote avec une estimations de 10 13 cellules bactériennes et plus de 1000 espèces différentes :
- les Bacteroidetes
- les Firmicutes
- les Actinobactéries
- les Protéobactéries.
Les Bacteroidetes et Firmicutes représentent environ 90 à 99 % du microbiote.

Il est important de noter que cette représentation schématique ne montre qu’une compréhension générale de la dysbiose et de l’eubiose. Au niveau phylum, par exemple, le rapport Firmicutes, Bacteroides/Proteobacteria et Actinobacteria peut différer dans certaines maladies auxquelles la dysbiose a été associée. La partie centrale de
la figure illustre les fonctions du microbiome intestinal qui restent à élucider par des techniques avancées telles que les analyses métatranscriptomiques, métagénomiques, protéomiques et métabolomiques, qui peuvent éventuellement établir une causalité plutôt qu’une association dans un avenir proche. Un astérisque représente les microorganismes indigènes ayant une capacité pathogène qui, dans des circonstances normales, sont maintenus à de faibles niveaux.
2. Dysbiose
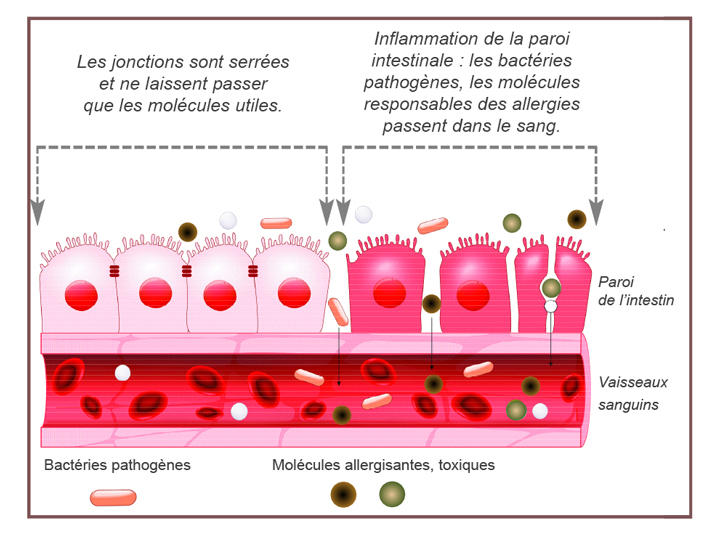
La dysbiose intestinale se produit lorsqu’un déséquilibre entre les bactéries bénéfiques et nuisibles transforme la communauté. Les espèces normalement dominantes sont supplantées par des microbes autrement sous-représentés qui augmentent en abondance ; plusieurs groupes ont montré une augmentation de la dégradation du mucus et une diminution subséquente de l’intégrité de la muqueuse intestinale engendrant une « inflammation de bas grade » systémique reconnue pour être impliquée dans les maladies de civilisation c’est à dire les maladies neurodégénératives, le diabète de type 2, les pathologies cardiovasculaires, les cancers,les maladies inflammatoires de l’intestin….
La réduction de l’abondance des Bacteroidetes et l’augmentation proportionnelle des Firmicutes est associée à l’obésité.
Une alimentation riche en glucides non digestibles augmente le ratio des Bacteroidetes, réduisant l’IMC, la glycémie à jeun, améliorant le profil lipidique (cholestérol total, LDL) ainsi que les marqueurs systémiques de l’inflammation (protéine C-réactive et IL6), l’HbA1c, le GLP1 chez les patients présentant un diabète de type 2.
Un régime riche en graisses saturées est associé à une augmentation des bactéries gram négatives libérant des lipopolysaccharide (LPS), formé à partir de la dégradation des bactéries Gram-négatives dans l’intestin, ces LPS sont responsables d’une inflammation de bas grade responsable entre autre d’une augmentation de la glycémie à jeun, de l’insulinémie, d’une résistance à l’insuline, ,d’une hépatite non alcoolique, d’une augmentation du tissu adipeux.

Les écosystèmes microbiens peuvent rapidement modifier leur fonctionnalité en réponse aux changements alimentaires. Parmi les différentes variables environnementales, les interventions alimentaires à court terme couplées à des schémas alimentaires à long terme régulent la physiologie du microbiote intestinal (MI).
Les processus liés au métabolisme des nutriments et des xénobiotiques affectent les mécanismes suivants :
- la diaphonie chimique entre les composés issus du métabolisme microbien et humain
- la modulation du système immunitaire
- la protection contre les agents pathogènes
- la régulation du système nerveux entérique
- la résistance au cancer colorectal
- le comportement neurologique
- la réduction des taux de lipides dans le sérum et l’équilibrage du cholestérol
3. La diaphonie
L’environnement nutritionnel, social, comportemental et géographique joue un rôle sur la génétique de l’hôte (phénomène épigénétique) et l’adaptation du MI qui s’ensuit déclenche les mécanismes moléculaires de communication entre le microbiome et l’hôte, ce que l’on appelle la diaphonie.
4. Perturbation du microbiote intestinal associée à différentes pathologies
1. Les Maladies autoimmunes
L’immunité
 Les métabolites des bactéries commensales dérivés de l’interaction avec les nutriments peuvent réguler le système immunitaire de l’hôte. Les bactéries commensales sont d’importants régulateurs de la digestion et le contenu intestinal est un mélange de microbes qui sont importants pour le traitement et l’absorption de plusieurs nutriments et métabolites, notamment les acides biliaires, les lipides, les acides aminés (AA), les vitamines et les acides gras à chaîne courte. (AGCC). Ces nutriments et métabolites qui dérivent de bactéries commensales sont directement liés à l’alimentation et à la digestion et peuvent moduler les cellules immunitaires par des mécanismes directs et indirects pouvant affecter notre santé.
Les métabolites des bactéries commensales dérivés de l’interaction avec les nutriments peuvent réguler le système immunitaire de l’hôte. Les bactéries commensales sont d’importants régulateurs de la digestion et le contenu intestinal est un mélange de microbes qui sont importants pour le traitement et l’absorption de plusieurs nutriments et métabolites, notamment les acides biliaires, les lipides, les acides aminés (AA), les vitamines et les acides gras à chaîne courte. (AGCC). Ces nutriments et métabolites qui dérivent de bactéries commensales sont directement liés à l’alimentation et à la digestion et peuvent moduler les cellules immunitaires par des mécanismes directs et indirects pouvant affecter notre santé.

De fortes concentrations d’AGCC dans l’intestin sont la résultante d’une consommation élevée de fibres alimentaires ces AGCC sont impliqués dans l’immunomodulation. Les protéines G couplées à un récepteur transmembranaire (GCPR) sont des détecteurs de métabolites responsables des effets des fibres/SCFA sur la santé intestinale et l’immunité.
Les 7 principales actions des AGCC
(1) « exclusion concurrentielle » par laquelle un régime à haute teneur en fibres élargit les bactéries commensales et limite l’accès des bactéries pathogènes à l’épithélium intestinal.
(2) Les AGCC favorisent la sécrétion de mucus par les cellules épithéliales intestinales. La barrière muqueuse est l’un des éléments les plus importants pour la séparation physique des bactéries de la surface épithéliale.
(3) Les AGCC favorisent la sécrétion d’IgA par les cellules B. L’IgA joue un rôle clé dans le maintien d’une relation mutualiste entre l’hôte et le microbiote intestinal et les AGCC peuvent influencer la production d’IgA.
(4) Les AGCC favorisent la réparation des tissus et la cicatrisation des plaies. Cela peut être particulièrement important dans le tractus gastro-intestinal car les ulcères, les dommages physiques ou les actions des parasites nécessiteraient des processus constants de cicatrisation des plaies.
(5) Les AGCC favorisent le développement de Treg dans l’intestin, dans un processus qui facilite vraisemblablement la tolérance immunologique aux antigènes alimentaires et possiblement à certaines bactéries commensales.
(6) Les SCFA (en particulier l’acétate) améliorent l’intégrité épithéliale dans un processus dépendant de l’activation d’inflammasome et de la production d’IL-18.
(7) Les AGC ont des effets anti-inflammatoires bien établis, en particulier une inhibition de la NF-κb.

Voies par lesquelles le microbiome intestinal peut influencer l’appariton des maladies auto-immunes
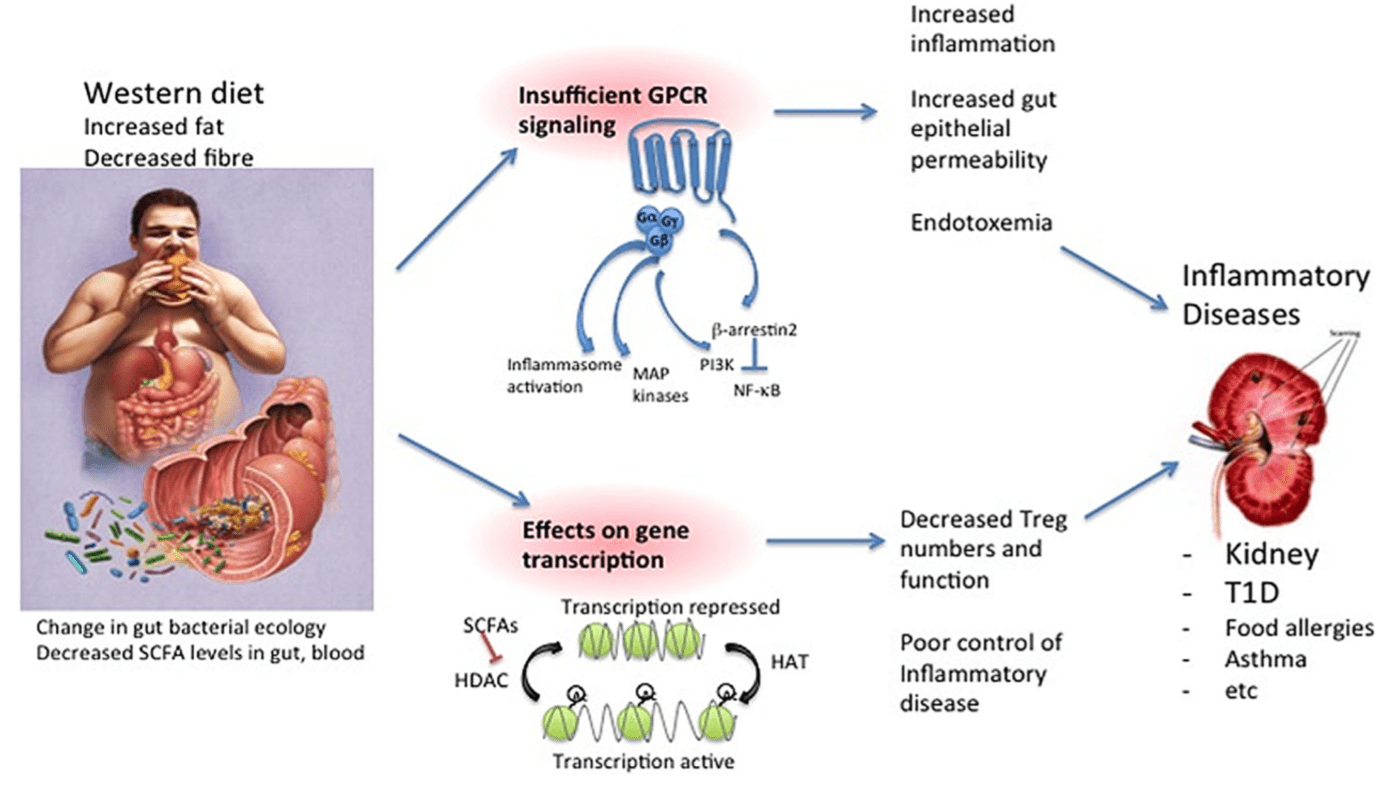
A gauche, une alimentation « occidentale » riche en graisses saturées et pauvre en fibres, l’utilisation d’antibiotiques vont induire une modification du microbiote digestif responsable d’une dysbiose engendrant une diminution de la production d’AGCC, de mucus et une perte d’intégrité de la barrière digestive permettant la translocation de LPS, de bactéries, de virus, de particules alimentaires, activant le système immunitaire en mode inflammation.
A droite sont représentés les mécanismes moléculaires par lesquels les métabolites intestinaux peuvent favoriser l’homéostasie intestinale et protéger contre la maladie.
- La première est par des réponses immédiates, médiées par des GCPR métabolisants (haut de la figure) qui signalent par diverses voies, mais en particulier β-arrestin2 (qui produit des effets antiinflammatoires), ou par des protéines G comme Gαi ou Gq.
- Le deuxième mécanisme par lequel les AGCC affectent la biologie est par des effets sur la transcription des gènes. Les AGCC inhibent l’activité des HDAC, qui désactivent les protéines d’histone. Cette inhibition des HDAC est un mécanisme de régulation de la transcription des gènes. Un autre mécanisme non listé ici est l’agonisme direct des facteurs de transcription tels que l’AhR par certains métabolites.
La sclérose en plaque
 La sclérose en plaques (SEP) est une maladie démyélinisante chronique et inflammatoire du système nerveux central (SNC). Cette pathologie auto-immune touche environ 2,5 millions de personnes et elle est plus fréquente chez les femmes que chez les hommes.
La sclérose en plaques (SEP) est une maladie démyélinisante chronique et inflammatoire du système nerveux central (SNC). Cette pathologie auto-immune touche environ 2,5 millions de personnes et elle est plus fréquente chez les femmes que chez les hommes.L’axe intestin-cerveau : le rôle du microbiote intestinal dans la physiopathologie de la SEP
 Le microbiote intestinal joue un rôle crucial dans la régulation des processus physiologiques tels que le métabolisme et l’immunité. Les métabolites du microbiote intestinal ont le potentiel de prévenir l’inflammation via leurs interactions avec le SNC.
Le microbiote intestinal joue un rôle crucial dans la régulation des processus physiologiques tels que le métabolisme et l’immunité. Les métabolites du microbiote intestinal ont le potentiel de prévenir l’inflammation via leurs interactions avec le SNC.
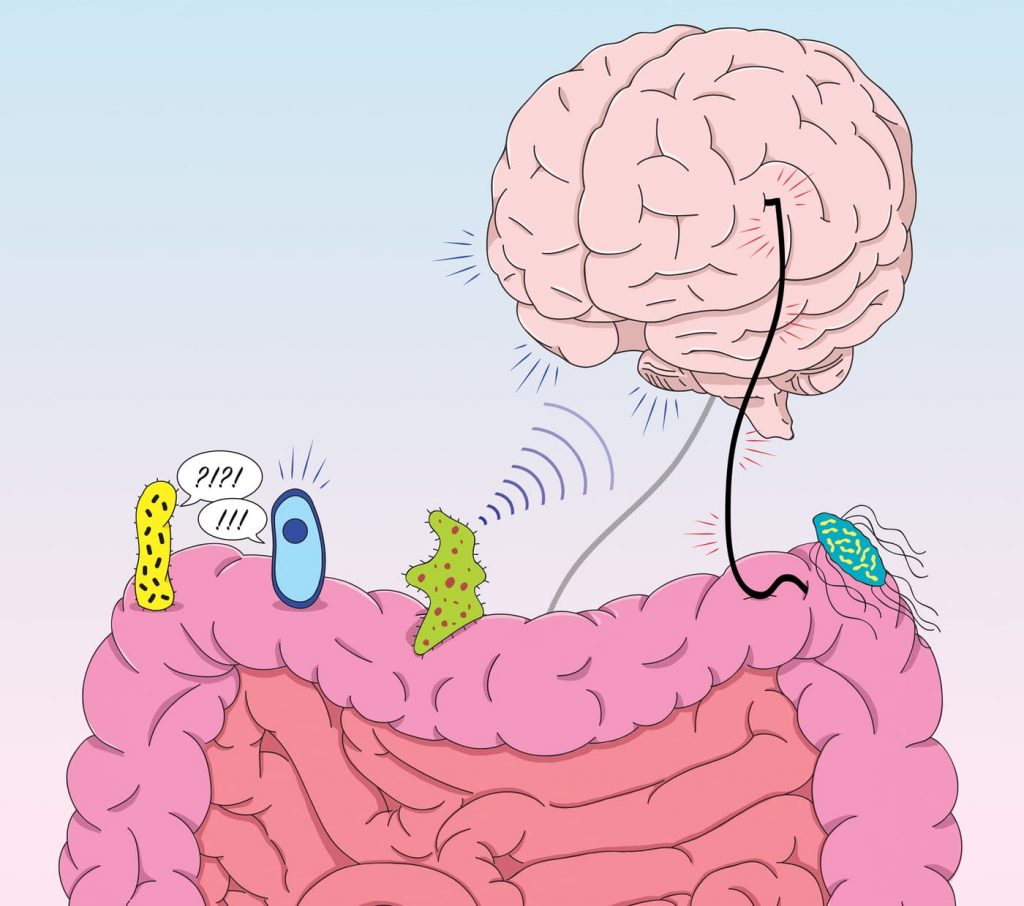
Il existe un axe intestin-microbiote-cerveau dans le corps humain qui contrôle la communication biochimique entre le SNC et le système nerveux entérique (SNE) du tractus gastro-intestinal (TGI) qui semble être médiée par le microbiote intestinal.
La voie afférente communique les signaux du tractus gastro-intestinal au SNC, tandis que la voie efférente communique les signaux du SNC au tractus gastro-intestinal. Les nerfs vagues sont impliqués dans les fonctions afférentes et peuvent reconnaître la présence de produits microbiens et de composants de la paroi cellulaire, et les signaux neuronaux efférents peuvent affecter la motilité gastro-intestinale, la sécrétion et la perméabilité épithéliale. Les effets de tels signaux efférents modifient la composition du microbiote intestinal en modifiant l’environnement physique.
Le microbiote intestinal joue un rôle important dans le processus de fermentation, convertissant les glucides non digestibles en acétate, propionate et butyrate – les trois SCFA principaux. Les SCFA sont connus pour diminuer l’inflammation et inhiber la production d’histone désacétylase, et des preuves récentes suggèrent que les SCFA jouent un rôle déterminant dans l’homéostasie neuro-immune.
Les AGCC peuvent activer la réponse immunitaire du cerveau pour inhiber l’histone désacétylase par le biais de mécanismes épigénétiques. Cette inhibition induit alors la production de cellules T régulatrices (cellules Treg) dans l’intestin. Les cellules Treg jouent un rôle dans le maintien de la barrière hémato-encéphalique et la régulation de l’activité de la microglie du SNC.
Les AGCC peuvent affecter l’homéostasie et la maturation du SNC. De plus, les AGCC sont considérés comme des molécules anti-inflammatoires.
La production d’AGCC varie en fonction de la composition du microbiote intestinal, qui, à son tour, est affectée par le type et la quantité de fibres alimentaires consommées.

(B) Les modèles animaux suggèrent que les maladies auto-immunes, y compris la SEP, pourraient être associées à une dysbiose intestinale, une augmentation de la perméabilité intestinale, une translocation microbienne et une inflammation locale et systémique. Les médiateurs inflammatoires, tels que le TNF-α, sont connus pour réduire l’expression des protéines des jonctions serrées augmentant ainsi la perméabilité de la barrière intestinale.
(C) Les preuves expérimentales obtenues dans des modèles animaux suggèrent également que les interventions déplaçant les réponses immunitaires vers des voies immunorégulatrices basées sur des cellules régulatrices produisant des cytokines anti-inflammatoires telles que l’IL-10, le TGF-β ou l’IL-35 peuvent restaurer l’homéostasie immunitaire et protéger contre la démyélinisation inflammatoire du SNC. Des médiateurs inflammatoires réduits ainsi que la production directe de métabolites tels que SCFA (acides gras à courtes chaines) par le microbiome équilibré faciliteraient l’augmentation de l’intégrité épithéliale compromise. CSFA : acides gras à chaîne courte ; SNC : système nerveux central ; MS : sclérose en plaques ; EAE : encéphalomyélite auto-immune expérimentale ; CD : cluster de différenciation ; Th : T assistant ; IL : interleukine ; TNF : facteur de nécrose tumorale ; TGF : facteur de croissance transformant.
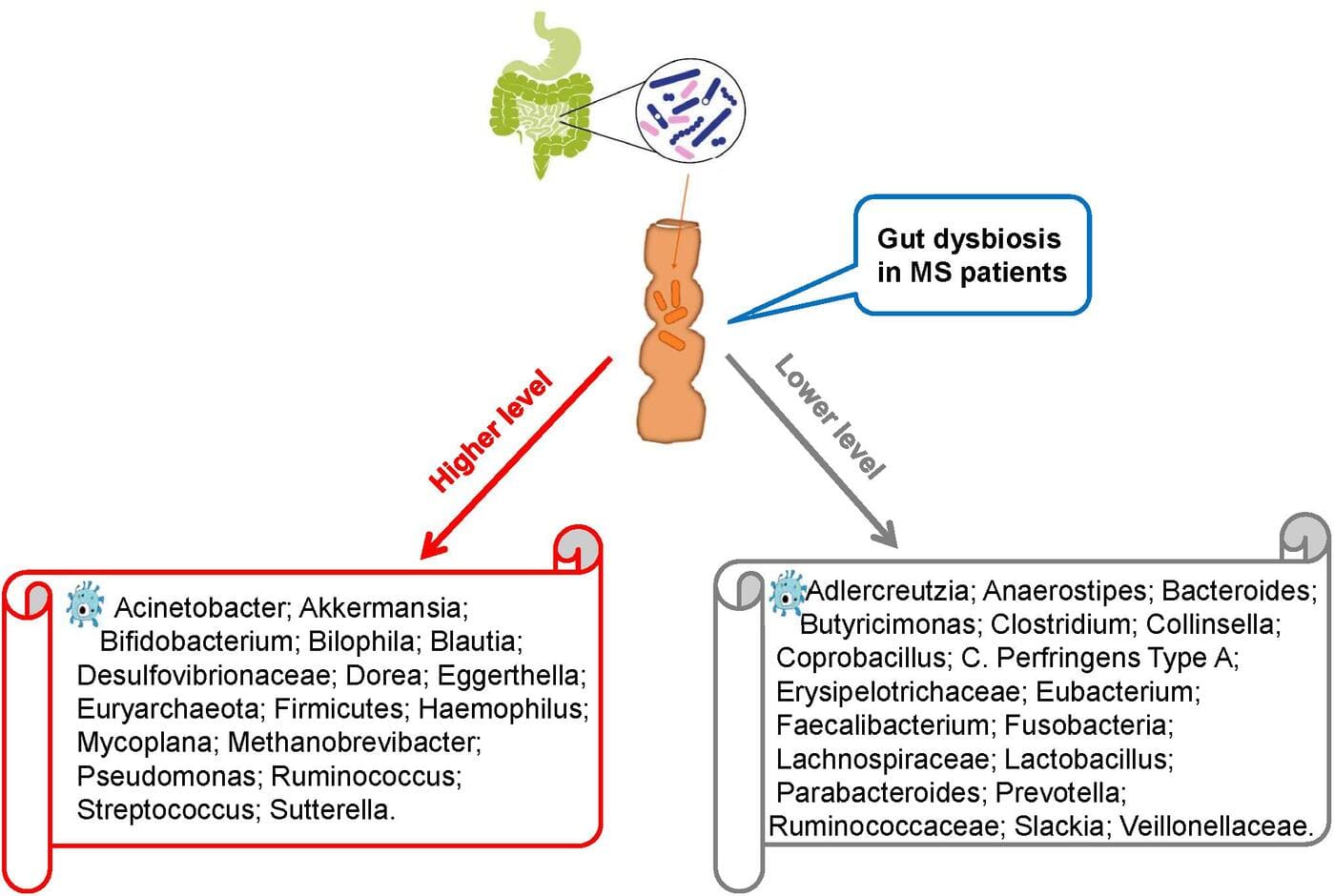
Des études récentes comparant le microbiote intestinal présent dans les selles de patients atteints de SEP et d’individus sains ont révélé une dysbiose intestinale chez des patients atteints de SEP.
Thérapies ciblées sur le microbiote pour la SEP
De nombreuses approches holistiques modernes pour les soins de santé se concentrent sur la promotion d’un microbiote intestinal bénéfique. Les traitements ciblant le microbiote comprennent des modifications alimentaires, des greffes de microbiote fécal (FMT) et l’administration de probiotiques et de prébiotiques.
Modifications alimentaires
 Les habitudes alimentaires pourraient être le principal déterminant de la composition et de la fonction microbienne de l’intestin façonnant ainsi la structure microbienne. En général, les régimes occidentaux hypercaloriques et riches en graisses animales peuvent accélérer l’anabolisme, modifier la composition du microbiote intestinal et entraîner une dysbiose intestinale. A l’inverse, une alimentation riche en fibres favorise l’eubiose intestinale. Les régimes alimentaires occidentaux réduisent la production d’AGCC par le microbiote intestinal. Cette réduction des AGCC, qui facilitent la production de cellules Treg protectrices, pourrait ainsi augmenter l’incidence des maladies auto-immunes.
Les habitudes alimentaires pourraient être le principal déterminant de la composition et de la fonction microbienne de l’intestin façonnant ainsi la structure microbienne. En général, les régimes occidentaux hypercaloriques et riches en graisses animales peuvent accélérer l’anabolisme, modifier la composition du microbiote intestinal et entraîner une dysbiose intestinale. A l’inverse, une alimentation riche en fibres favorise l’eubiose intestinale. Les régimes alimentaires occidentaux réduisent la production d’AGCC par le microbiote intestinal. Cette réduction des AGCC, qui facilitent la production de cellules Treg protectrices, pourrait ainsi augmenter l’incidence des maladies auto-immunes.
Les régimes hypocaloriques comprenant des niveaux élevés de fruits, de légumes et de poisson favorisent un microbiote intestinal bénéfique et réduisent l’inflammation dans le corps.
Les probiotiques
Les probiotiques produisent des vitamines essentielles et des cofacteurs non produits naturellement par l’hôte, ils participent à l’immunomodulation et l’inhibition de la croissance du microbiote responsable de la dysbiose. L’administration de probiotiques réduit les symptômes des maladies du SNC. Cependant, très peu d’études ont évalué les effets des probiotiques sur les patients atteints de SEP.
Prébiotiques et polyphénols
 Les substances prébiotiques ont un effet significatif sur le microbiote. Les aliments à effet prébiotique comprennent les fruits colorés, le cacao et les feuilles de thé. Plusieurs glucides fermentescibles ont également des propriétés prébiotiques mais, deux oligosaccharides, les fructanes et les galactanes, sont connus pour être les plus bénéfiques pour la croissance de Bifidobacterium .
Les substances prébiotiques ont un effet significatif sur le microbiote. Les aliments à effet prébiotique comprennent les fruits colorés, le cacao et les feuilles de thé. Plusieurs glucides fermentescibles ont également des propriétés prébiotiques mais, deux oligosaccharides, les fructanes et les galactanes, sont connus pour être les plus bénéfiques pour la croissance de Bifidobacterium .
Une alimentation riche en fibres est couramment recommandée en raison de ses bienfaits pour la santé. Ses effets protecteurs dans la SEP sont associés à la capacité du microbiote intestinal à produire des AGCC en fermentant les fibres alimentaires.
Une alimentation riche en polyphénols peut protéger contre la SEP ces patients peuvent bénéficier d’un apport en polyphénols alimentaires en plus des probiotiques et des prébiotiques.
TMF et thérapie de greffe de substitut de selles
La greffe de microbiote fécal implique le remplacement de l’ensemble du microbiome intestinal de l’hôte pour rétablir l’équilibre microbien souhaitable. Il est de plus en plus utilisé pour lutter contre diverses maladies.
Conclusion
Le développement de la SEP est influencé par des facteurs génétiques et environnementaux. Le microbiote commensal est l’un des facteurs de risque environnementaux liés au développement de la SEP.
Cette dysbiose chez les patients atteints de SEP a un effet pro-inflammatoire.
Par ces interventions thérapeutiques qui modifient le microbiote intestinal afin de favoriser le développement de « bons » micro-organismes à action anti-inflammatoire, tels que Lactobacilli , Bacteroides et Prevotella, il est possible d’envisager de réduire l’apparition des rechutes cliniques de la maladie chez les patients atteints de SEP. Ainsi, une alimentation saine et équilibrée joue un rôle protecteur dans l’évolution de la maladie, également par une modification de la composition du microbiote intestinal. Il est donc important de modifier la qualité des graisses introduites en limitant les graisses saturées et les graisses hydrogénées et en privilégiant la consommation de lipides mono et polyinsaturés. De plus, le bon apport en vitamines, sels minéraux et antioxydants doit être garanti, notamment dans les fruits et légumes. Parmi les vitamines, l’introduction de la vitamine D semble être très importante, car les personnes atteintes de SEP en sont souvent carencées. Il est également important de prévenir le surpoids, qui peut aggraver le handicap.
Bibliographie
-
Role of Dietary Lipids in Modulating Inflammation through the Gut Microbiota. Paul J. Wisniewski, Robert A. Dowden, Sara C. Campbell. Nutrients 2019, 11(1), 117; https://doi.org/10.3390/nu11010117
-
The Gut Microbiota: A Clinically Impactful Factor in Patient Health and Disease. David Avelar Rodriguez1 & Rubén Peña Vélez, Erick Manuel Toro Monjaraz, Jaime Ramirez Mayans & Paul MacDaragh Ryan. SN Comprehensive Clinical Medicine. https://doi.org/10.1007/s42399-018-0036-1
-
Gut Microbiota Metabolism and Interaction with Food Components. Paméla Vernocchi, Federica Del Chierico, Prof. Dr. Lorenza Putignani. Int. J. Mol. Sci. 2020, 21(10), 3688; https://doi.org/10.3390/ijms21103688
-
Diet, the Gut Microbiome, and Autoimmune Diseases. Charles R. Mackay. The Autoimmune Diseases, 6th. Copyright © 2020 Elsevier Inc. https://doi.org/10.1016/B978-0-12-812102-3.00019-1
-
The Gut–CNS Axis in Multiple Sclerosis. Atsushi Kadowaki, Francisco J. Quintana. Trends in Neuroscience REVIEW| VOLUME 43, ISSUE 8, P622-634, AUGUST 01, 2020. https://doi.org/10.1016/j.tins.2020.06.002
-
The Gut Microbiota in Multiple Sclerosis: An Overview of Clinical Trials. Giovanni Schepic, Serena Silvestro, Placido Bramanti, and Emanuela Mazzon. Cell Transplant. 2019 Dec; 28(12): 1507–1527. doi: 10.1177/0963689719873890
- Dietary Modulation of Intestinal Microbiota: Future Opportunities in Experimental Autoimmune Encephalomyelitis and Multiple Sclerosis. Yuying Fan, Junmei Zhang. REVIEW article. Front. Microbiol., 16 April 2019 | https://doi.org/10.3389/fmicb.2019.00740
-
The Gut Microbiome in Multiple Sclerosis: A Potential Therapeutic Avenue. Trevor O. Kirby and Javier Ochoa-Reparaz. Méd. Sci. 2018 , 6 (3), 69 ; https://doi.org/10.3390/medsci6030069