Introduction
 L’athérosclérose est une maladie inflammatoire chronique affectant les vaisseaux artériels et conduisant à des maladies vasculaires telles que les accidents vasculaires cérébraux et l’infarctus du myocarde. La relation entre l’athérosclérose et le risque de neurodégénérescence a été établie, en particulier avec les troubles cognitifs vasculaires et la démence (TCVD). L’athérosclérose systémique augmente le risque de TCVD en induisant un infarctus cérébral, ou par des facteurs inflammatoires systémiques ou locaux qui sont à l’origine à la fois l’athérosclérose et des vtroubles de la mémoire. Les acides gras polyinsaturés (AGPI) oméga-3 et oméga-6 sont impliqués dans les processus inflammatoires, mais avec des rôles opposés. Plus précisément, les AGPI oméga-3 exercent des propriétés anti-inflammatoires en rivalisant avec les AGPI oméga-6 et en déplaçant l’acide arachidonique dans les phospholipides membranaires, diminuant la production d’eicosanoïdes pro-inflammatoires.
L’athérosclérose est une maladie inflammatoire chronique affectant les vaisseaux artériels et conduisant à des maladies vasculaires telles que les accidents vasculaires cérébraux et l’infarctus du myocarde. La relation entre l’athérosclérose et le risque de neurodégénérescence a été établie, en particulier avec les troubles cognitifs vasculaires et la démence (TCVD). L’athérosclérose systémique augmente le risque de TCVD en induisant un infarctus cérébral, ou par des facteurs inflammatoires systémiques ou locaux qui sont à l’origine à la fois l’athérosclérose et des vtroubles de la mémoire. Les acides gras polyinsaturés (AGPI) oméga-3 et oméga-6 sont impliqués dans les processus inflammatoires, mais avec des rôles opposés. Plus précisément, les AGPI oméga-3 exercent des propriétés anti-inflammatoires en rivalisant avec les AGPI oméga-6 et en déplaçant l’acide arachidonique dans les phospholipides membranaires, diminuant la production d’eicosanoïdes pro-inflammatoires.
La majorité des syndromes coronariens aigus sont causés par la rupture de plaques rendues vulnérables par des lipides oxydés, une inflammation et une fine coiffe fibreuse avec une teneur réduite en collagène et en cellules musculaires lisses. La stabilisation et la réduction des plaques athéromateuses vulnérables peuvent aider à prévenir les événements cardiovasculaires. À cet égard, les acides gras oméga-3 à longue chaîne ont une pléthore d’effets bénéfiques permettant de stabiliser les plaques athéromateuses vulnérables, ils participent également à la réduction de cette plaque.
1. Un aperçu de leurs voies métaboliques
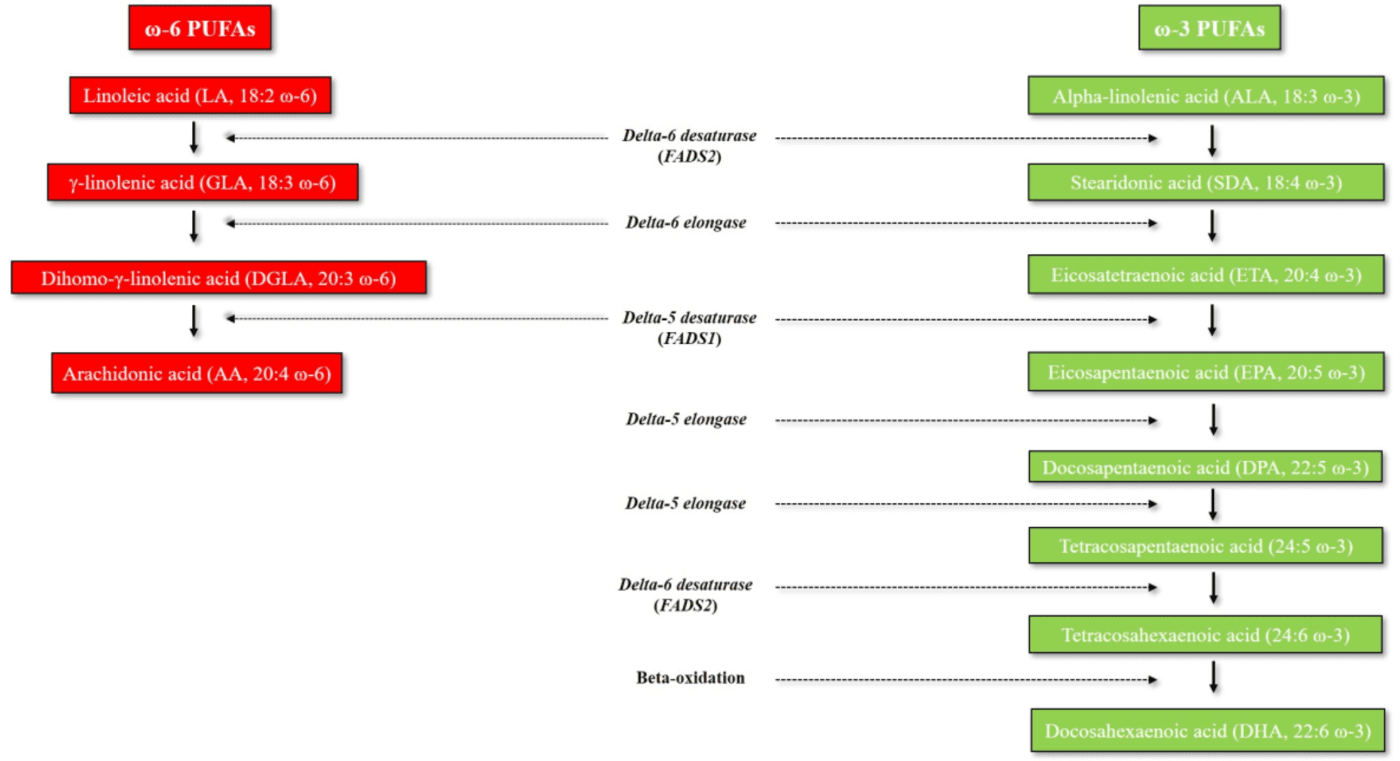
Les AGPI oméga-3 et oméga-6 sont caractérisés par la présence d’une double liaison à trois et six atomes de l’extrémité méthyle, respectivement.
Les AGPI oméga-3 et oméga-6 à longue chaîne dérivent respectivement de l’acide alpha-linolénique (ALA, 18:3 -3) et de l’acide linoléique (LA, 18:2 ω-6). ALA et LA sont appelés acides gras essentiels (AGE), car les mammifères ne peuvent pas les synthétiser en raison du manque de désaturases delta-12 et delta-15, qui sont des enzymes uniquement présentes dans les algues et les plantes marines. Les humains doivent donc obtenir des AGE par le biais de sources alimentaires. Les principales sources alimentaires d’ALA sont représentées par les produits laitiers et diverses graines et huiles de graines (en particulier les graines de lin et l’huile de noix), tandis que les huiles de maïs, de carthame et de tournesol sont particulièrement riches en LA. Les humains sont capables de métaboliser l’ALA et de synthétiser en aval différents AGPI oméga-3 à très longue chaîne et plus insaturés, notamment l’acide eicosapentaénoïque (EPA, 20:5 -3), l’acide docosapentaénoïque (DPA, 22:5 ω-3) et le docosahexaénoïque acide (DHA, 22:6 -3) – par de multiples réactions enzymatiques d’élongation et de désaturation qui se produisent principalement dans le foie. Cependant, les AGPI oméga-3 à très longue chaîne peuvent également être directement obtenus via différentes sources alimentaires (huile de foie de morue, poissons gras, huiles d’algues). L’acide arachidonique AGPI oméga-6 (AA, 20:4 -6) peut soit être obtenu à partir de certaines sources alimentaires (en particulier la viande, le jaune d’œuf et les produits laitiers) soit être synthétisé de manière endogène à partir du précurseur oméga-6 LA à travers une série de réactions enzymatiques d’élongation et de désaturation. Les désaturases delta-5 et delta-6 (codées par les gènes FADS1 et FADS2 , respectivement) sont les enzymes limitant la vitesse du métabolisme des AGPI et, par conséquent, les principaux déterminants des niveaux d’AGPI.
2. Rôle des oméga-3 et oméga-6 dans l’inflammation systémique
Les médiateurs lipidiques dérivés des AGPI oméga-6 AA sont impliqués dans l’inflammation à différents stades.
 En particulier, l’initiation de l’inflammation aiguë est régulée par plusieurs médiateurs lipidiques, dont les eicosanoïdes prostaglandines (PG), thromboxanes (TX) et leucotriènes (LT) qui jouent un rôle pivot :
En particulier, l’initiation de l’inflammation aiguë est régulée par plusieurs médiateurs lipidiques, dont les eicosanoïdes prostaglandines (PG), thromboxanes (TX) et leucotriènes (LT) qui jouent un rôle pivot :
- dans la modulation du flux sanguin,
- la perméabilité endothéliale,
- les polynucléaires neutrophiles. (PMN) chimiotaxie
- agrégation plaquettaire.
Les enzymes cyclooxygénase (COX) et lipoxygénase (LO) catalysent la conversion de l’AA en une série de médiateurs pro-inflammatoires, notamment les PG, la prostacycline (PGI2), le TXA2 et les leucotriènes pro-inflammatoires, également connus sous le nom de leucotriènes de la série 4.
Les AGPI oméga-3 exercent des propriétés anti-inflammatoires
En rivalisant avec les AGPI oméga-6 et en déplaçant l’AA dans les phospholipides membranaires, réduisant ainsi la production d’eicosanoïdes pro-inflammatoires. En particulier, l’EPA est également un substrat pour les enzymes de la cascade AA (COX, 5-LO), conduisant à la production d’autres eicosanoïdes dérivés des AGPI oméga-3, tels que les prostanoïdes de la série 3 et les leucotriènes de la série 5. Malgré leur structure et leur stabilité similaires, les eicosanoïdes dérivés de l’EPA sont des métabolites inactifs et présentent une activité pro-inflammatoire inférieure à celle des eicosanoïdes dérivés de l’AA.
En particulier, l’EPA est également un substrat pour les enzymes de la cascade AA (COX, 5-LO), conduisant à la production d’autres eicosanoïdes dérivés des AGPI oméga-3, tels que les prostanoïdes de la série 3 et les leucotriènes de la série 5. Malgré leur structure et leur stabilité similaires, les eicosanoïdes dérivés de l’EPA sont des métabolites inactifs et présentent une activité pro-inflammatoire inférieure à celle des eicosanoïdes dérivés de l’AA.
Les AGPI oméga-3 jouent un rôle anti-inflammatoire notamment en favorisant la résolution de l’inflammation. En fait, ils sont précurseurs d’une série de médiateurs lipidiques, dont les résolvines, les protectines et les maresines, qui sont collectivement appelés « médiateurs pro-résolvants spécialisés » (SPM). Les SPM sont produites par les PMN et les macrophages lors de la résolution de l’inflammation, stimulant des événements cellulaires clés :
- l’arrêt de l’infiltration des PMN,
- le passage des macrophages au phénotype anti-inflammatoire M2
- la clairance cellulaire apoptotique.
Les SPM sont synthétisés par une série complexe de réactions enzymatiques médiées par les enzymes COX-2, P450 et LO acétylées. L’EPA représente le précurseur des résolvines de la série E (RvE1, RvE2 et RvE3), tandis que le DHA conduit à la production de trois familles distinctes de SPM, à savoir les résolvines de la série D (RvD1, RvD2, RvD3, RvD4), les protectines (protectine D1, connue sous le nom de neuroprotectine D1 [NPD1] lorsqu’elle est formée dans le système nerveux), et les maresines (MaR1).
la majorité des AGPI oméga-3 et oméga-6 sont ingérés par l’alimentation. En raison des changements spectaculaires observés dans les habitudes alimentaires au cours des décennies, les régimes alimentaires occidentaux ont progressivement évolué vers une quantité accrue d’AGPI oméga-6 par rapport aux AGPI oméga-3. Il a donc été suggéré que le déséquilibre alimentaire entre les AGPI oméga-6 et oméga-3 joue un rôle dans le déclenchement de l’inflammation systémique et augmente ainsi le risque de plusieurs maladies chroniques, telles que l’obésité, les maladies cardiovasculaires (MCV) et les maladies auto-immunes. En particulier, le rapport sériques oméga-6 à oméga-3 chez les adultes a progressivement augmenté pour atteindre des valeurs allant de 15:1 à 25:1, ce qui est nettement élevé par rapport à ceux qui prévalaient dans l’alimentation de nos ancêtres,oméga-6 à oméga-3 avec un rapport d’environ 1:1. Les oméga-6 représentent le principal AGPI dans la plupart des régimes alimentaires occidentaux et est consommé en quantité 5 à 20 fois plus élevée que les oméga-3. Il est important de noter que les oméga-3 et oméga-6 sont en compétition pour les mêmes enzymes de désaturation. Même si les désaturases delta-5 et delta-6 préfèrent l’ALA à l’LA comme substrat, un apport alimentaire élevé en LA – comme celui observé dans la plupart des régimes occidentaux – interfère avec la désaturation et l’allongement de l’ALA en AGPI oméga-3 à longue chaîne. (EPA, DPA et DHA).

3. Pathogenèse de l’athérosclérose, des troubles cognitifs vasculaires et de la démence : rôle de l’inflammation
 La démence vasculaire (DV) et la déficience cognitive vasculaire (DCV), résultent de facteurs de risque de maladie cérébrovasculaire tels que la fibrillation auriculaire, le diabète, l’hypertension et la dyslipidémie.
La démence vasculaire (DV) et la déficience cognitive vasculaire (DCV), résultent de facteurs de risque de maladie cérébrovasculaire tels que la fibrillation auriculaire, le diabète, l’hypertension et la dyslipidémie.4. Rôle des oméga-3 et oméga-6 dans l’athérosclérose, les maladies cardiovasculaires et l’inflammation vasculaire
Les oméga-3 peuvent réduire la voie inflammatoire dans l’athérosclérose à la fois en réduisant la production d’eicosanoïdes pro-inflammatoires et en augmentant la synthèse de SPM.
Les régions vulnérables des plaques d’athérosclérose carotidienne humaine présentent des niveaux significativement plus bas de médiateur pro-résolution RvD1, ainsi que des niveaux significativement plus élevés de médiateur pro-inflammatoire LTB4. L’administration exogène de RvD1 à des souris modifie le rapport RvD1 / LTB4 réduit les lésions athérosclérotiques et est capable de promouvoir les caractéristiques de stabilité de la plaque. .
Un rapport salivaire RvD1/LTB4 plus élevé est significativement associé à une épaisseur inférieure de l’intima média chez les personnes atteintes d’athérosclérose infraclinique.
L’indice omega 3
L’indice oméga-3 a été proposé comme biomarqueur permettant d’évaluer l’apport en omega 3 et considéré comme nouveau facteur de risque de décès par maladie coronarienne. L’indice oméga-3 est défini comme la teneur en EPA et en DHA des membranes des globules rouges, exprimée en pourcentage des acides gras totaux. En particulier, des scores d’indice oméga-3 à 8 % ou ≤ à 4 % étaient associés à la cardioprotection la plus élevée et la plus faible, respectivement. Ainsi, il a été suggéré que les essais cliniques évaluant le rôle de l’apport ou de la supplémentation en AGPI oméga-3 dans la santé CV devraient inclure l’indice oméga-3 dans la conception de l’étude, recruter des individus avec un indice faible et les traiter dans une plage cible spécifique. (par exemple, ≥8%) afin de donner lieu à des résultats plus précis.
5. Supplémentation en oméga-3 pour la prévention primaire et secondaire de l’athérosclérose et des maladies cardiovasculaires
les oméga-3 peuvent avoir un rôle bénéfique en termes de prévention des MCV lorsqu’ils sont administrés à des doses plus élevées. En fait, une explication possible du manque de bénéfices de la supplémentation en oméga-3 dans la plupart des études concernant les maladies CV peut être due aux doses relativement faibles administrées (≤ 1 g/jour). En effet, l’administration de doses élevées d’oméga-3 (entre 1,8 et 4 g/jour) entraînait une réduction significative de la morbidité et de la mortalité CV. Par conséquent, on peut supposer que les effets bénéfiques des AGPI oméga-3 à des doses élevées pourraient être médiés, au moins en partie, par leurs propriétés protectrices contre les processus inflammatoires, thrombotiques et athéroscléreux. Cela peut être dû au fait que des doses élevées d’AGPI oméga-3 pourraient être nécessaires pour atteindre des niveaux circulants élevés de SPM, comme cela a été démontré.
En résumé, c’est la vulnérabilité de la plaque, et non le degré de sténose luminale, qui est le déterminant majeur du risque d’événements athérothrombotiques. Les preuves globales suggèrent que la supplémentation en oméga-3 à longue chaîne réduit et peut remodeler positivement la formation de plaque athéroscléreuse. L’ensemble des preuves suggère également que la supplémentation en EPA/DHA des patients à haut risque, soit tôt après un syndrome coronarien aigu, soit en utilisant une dose élevée de 4 grammes d’EPA, réduit le risque d’événements de maladie coronarienne et/ou de maladie coronarienne, de mortalité.

6. Rôle des oméga-3 et oméga-6 dans les cellules neuronales
 La composition en acides gras du cerveau est unique : les cellules neuronales sont caractérisées par des taux élevés de palmitate (un acide gras saturé), d’oméga-6, mais de faibles taux d’oméga-3. Parmi les oméga-3 présents dans le tissu cérébral, l’oméga-3 le plus important quantitativement est le DHA, qui est 250 à 300 fois plus abondant que l’EPA. La synthèse cérébrale d’EPA et de DHA est faible, ce qui suggère que le cerveau maintient les niveaux d’acides gras via l’absorption de sources alimentaires ou hépatiques. En effet, l’EPA et le DHA peuvent traverser la barrière hémato-encéphalique par diffusion. Les niveaux cérébraux d’EPA sont maintenus bas par plusieurs mécanismes, notamment une diminution de l’incorporation, une bêta-oxydation et un recyclage plus faible des phospholipides.
La composition en acides gras du cerveau est unique : les cellules neuronales sont caractérisées par des taux élevés de palmitate (un acide gras saturé), d’oméga-6, mais de faibles taux d’oméga-3. Parmi les oméga-3 présents dans le tissu cérébral, l’oméga-3 le plus important quantitativement est le DHA, qui est 250 à 300 fois plus abondant que l’EPA. La synthèse cérébrale d’EPA et de DHA est faible, ce qui suggère que le cerveau maintient les niveaux d’acides gras via l’absorption de sources alimentaires ou hépatiques. En effet, l’EPA et le DHA peuvent traverser la barrière hémato-encéphalique par diffusion. Les niveaux cérébraux d’EPA sont maintenus bas par plusieurs mécanismes, notamment une diminution de l’incorporation, une bêta-oxydation et un recyclage plus faible des phospholipides.7. Rôle des oméga-3 et oméga-6 dans la maladie d’Alzheimer, les troubles cognitifs vasculaires et la démence
 Le vieillissement est caractérisé par une altération du métabolisme énergétique, qui comprend une augmentation du stress oxydatif et une augmentation de l’inflammation, pouvant entraîner une augmentation de la susceptibilité à l’athérosclérose.
Le vieillissement est caractérisé par une altération du métabolisme énergétique, qui comprend une augmentation du stress oxydatif et une augmentation de l’inflammation, pouvant entraîner une augmentation de la susceptibilité à l’athérosclérose.Les AGPI peuvent moduler de nombreuses voies de transduction du signal dans les cellules neuronales. Par conséquent, la neurodégénérescence liée à l’âge peut être prévenue en contrôlant ces voies :
- les apports en oméga-3 et oméga-6 influence divers aspects de la neurotransmission sérotoninergique et catécholaminergique, qui sont les premiers à être perdus au cours de la MA. Lorsque la phospholipase A2 (PLA2) hydrolyse les acides gras des phospholipides membranaires, elle libère des oméga-6, qui sont métabolisés en prostaglandines avec un potentiel inflammatoire plus élevé que ceux générés à partir des oméga-3. Ainsi, l’activité de PLA2, couplé à la composition altérée en acides gras membranaires typique du vieillissement, peut jouer un rôle central dans le développement du dysfonctionnement neuronal. En particulier, les AGPI augmentent à la fois les activités de la phospholipase C (PLC) et de la protéine kinase C (PKC) sur les membranes neuronales, qui sont impliquées dans la transmission adrénergique alpha-1 et peut moduler la PLA2, qui régule finalement la production de prostaglandines, de thromboxane et de leucotriènes.
- les taux plasmatiques élevés de DHA (mais pas d’EPA) ont un effet protecteur dans la prévention de la démence des taux plus élevés de DHA ont montré une réduction de 47 % du risque de développer une démence.
- le DHA joue un rôle régulateur dans la signalisation des protéines G. Les auteurs ont montré que le DHA a un rôle protecteur contre l’apoptose et joue un rôle dans la diminution des taux de phosphatidylsérine qui contrôlent la signalisation cellulaire et la prolifération cellulaire.
- le DHA joue un rôle anti-amyloïdogénique diminuant les troubles d’apprentissage liés à la MA.
- un transporteur de DHA a été identifié sur la barrière hémato-encéphalique. Ces deux propriétés nouvellement découvertes du DHA (ses propriétés anti-amyloïdogènes et sa capacité à traverser la barrière hémato-encéphalique) sont cruciales dans la pathogenèse et dans la prévention de la MA et de la TCVD.
- une carence en oméga-3 (EPA et DHA) peut entraîner une réduction de l’absorption du glucose dans le cerveau et à son tour une plus grande altération de la mémoire.

https://www.mdpi.com/2073-4409/9/2/506/htm
8. Supplémentation en AGPI oméga-3 pour la prévention de la maladie d’Alzheimer, des troubles cognitifs vasculaires et de la démence
Le cerveau vieillissant est plus sujet à la bêta-oxydation et aux altérations inflammatoires, qui sont des facteurs cruciaux pour le développement de modifications athéroscléreuses, d’accidents vasculaires cérébraux, des TCVD, d’une diminution de la plasticité synaptique et d’une dégradation des performances de la mémoire.
Rôle anti-infflammatoire des oméga-3 : nouvelle approche thérapeutique des TCVD et de la MA
- Diminution des taux de cytokines proinflammatoires. Le DHA a un effet plus puissant sur la diminution des cytokines libérées, l’EPA pourrait modifier plus efficacement le profil pro-inflammatoire vers un profil similaire à celui observé chez les témoins sains.
- La supplémentation en EPA est capable de contrecarrer l’augmentation liée à l’âge des niveaux d’IL-1 dans l’hippocampe de rats âgés.
- L »EPA peut réduire l’augmentation de l’IL-1 hippocampique induite par l’amyloïde-β chez les rats âgés.
- L’EPA et le DPA peuvent réduire le stress oxydatif et peuvent inverser les troubles de l’apprentissage spatial liés à l’âge.
4 Essais contrôles randomisé ont établi qu’un apport en oméga-3 allant de 1200 à 4000 mg améliorait les performances cognitives et diminuaient le stress oxydatif.
9. Nouvelles stratégies personnalisées pour prévenir l’athérosclérose, les troubles cognitifs vasculaires et la démence : accent sur le rapport AA/EPA et les AGPI oméga-3
La prévention représente le meilleur moyen de contrer l’athérosclérose et les TCVD. La principale stratégie consiste à contrôler les facteurs de risque vasculaire par une alimentation et un mode de vie adéquats et pharmacologiquement en cas de facteurs de risque vasculaire et de maladie manifeste. L’importance d’un régime méditerranéen, caractérisé par une consommation élevée de fruits, de légumes, de légumineuses, de poisson, de céréales et d’huile d’olive, ainsi qu’une faible consommation de lait, de viande et d’acides gras saturés est associée à un réduction significative du risque de déclin cognitif.
L’intégration des oméga-3 dans l’alimentation a suscité une grande attention pour la prévention de l’athérosclérose, des MCV et les TCVD étant donné l’association causale entre l’inflammation et ces maladies. Cependant, la dose appropriée d’oméga-3 pour obtenir des effets bénéfiques en termes de prévention primaire ou secondaire des maladies cardiovasculaires et des maladies inflammatoires n’est toujours pas claire. Le bénéfice réel de ce traitement soit avec un régime soit avec des compléments nutritionnels dépend des taux sériques et/ou tissulaires oméga-3.
Le rapport oméga-6/oméga-3 est d’une utilité limitée pour la prédiction du risque CV, alors que l’indice oméga-3 semble être un facteur de risque plus fiable pour les maladies cardiovasculaires. De plus, le rapport AA/EPA s’est avéré être un marqueur de substitution fiable du rapport oméga-6/oméga-3 qui peut servir d’indicateur plus spécifique de l’ampleur de l’inflammation cellulaire et à son tour du risque CV. Un rapport AA/EPA compris entre 1,5 et 3 a été suggéré comme la plage optimale afin de réduire l’inflammation cellulaire et d’obtenir des effets bénéfiques dans différents contextes cliniques.
Les oméga-3 à forte dose pourraient augmenter les niveaux de SPM et réduire la synthèse des eicosanoïdes et l’expression des cytokines pro-inflammatoires. Par conséquent, une dose précise d’oméga-3 doit être déterminée en fonction de plusieurs facteurs. Une dose d’environ 86 mg d’EPA et de DHA/kg de poids corporel/jour aurait un avantage significatif en termes de prévention contre les événements CV.
Il est important de noter qu’une dose de 5 g/jour d’EPA et de DHA a été établie pour réduire de manière significative le rapport AA/EPA de 23 à 2,5 chez les Caucasiens en bonne santé avec une réduction correspondante de l’inflammation. Néanmoins, même si 5 g/jour d’EPA et de DHA représentent une dose appropriée pour réduire considérablement le rapport AA/EPA, une supplémentation quotidienne avec 5 g d’EPA et de DHA doit être envisagée dans un cadre expérimental.
En général, une dose quotidienne d’EPA et de DHA de 2,5 g semble être suffisante pour abaisser le rapport AA/EPA dans la plage souhaitée pour un excellent bien-être pour les individus en bonne santé.
La capacité du rapport AA/EPA à donner un paramètre du traitement aux oméga-3 en termes d’effets anti-inflammatoires peut permettre le développement d’une thérapie personnalisée pour les maladies inflammatoires, y compris l’athérosclérose et les TCVD. Les oméga-3 peuvent induire une prévention précoce en agissant à différents niveaux de pathogenèse des TCVD, notamment en réduisant l’inflammation vasculaire et en diminuant l’activation des voies moléculaires nocives conduisant à l’accumulation de protéines mal repliées dans les neurones. Par conséquent, un apport en oméga-3 pourrait être particulièrement bénéfique, en particulier chez les sujets à haut risque de TCVD, tels que les patients diabétiques, hypertendus et dyslipidémiques.
9. Conclusions
Bibliographie
-
A Novel Anti-Inflammatory Role of Omega-3 PUFAs in Prevention and Treatment of Atherosclerosis and Vascular Cognitive Impairment and Dementia. Marialaura Simonetto, Marco Infante, Ralph L. Sacco, Tatjana Rundek and David Della-Morte. Nutrients 2019, 11(10), 2279; https://doi.org/10.3390/nu11102279
-
G-Protein-Coupled Receptors in CNS: A Potential Therapeutic Target for Intervention in Neurodegenerative Disorders and Associated Cognitive Deficits. Shofiul Azam, Md. Ezazul Haque, Md. Jakaria, Song-Hee Jo, In-Su Kim and Dong-Kug Choi. Cells 2020, 9(2), 506; https://doi.org/10.3390/cells9020506
-
The Secrets of the Mediterranean Diet. Does [Only] Olive Oil Matter? Alessandra Mazzocchi, Ludovica Leone, Carlo Agostoni and Isabella Pali-Schöll. Nutrients 2019, 11(12), 2941; https://doi.org/10.3390/nu11122941
-
Microbiota, a New Playground for the Omega-3 Polyunsaturated Fatty Acids in Cardiovascular Diseases. Guy Rousseau. Mar. Drugs 2021, 19, 54. https://www.mdpi.com/1660-3397/19/2/54