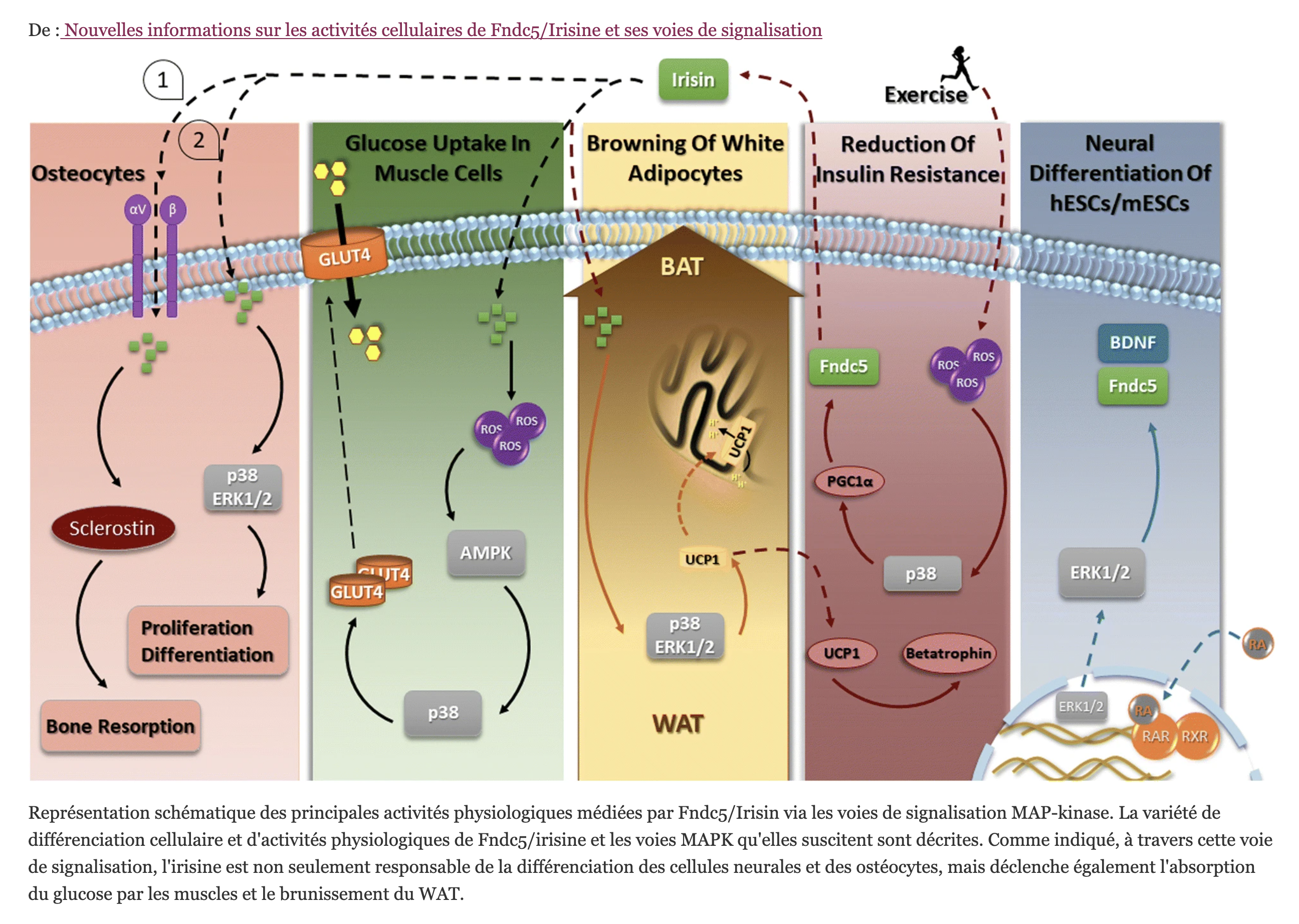
1. Introduction
 La maladie d’Alzheimer (MA), caractérisée par l’accumulation de plaques bêta-amyloïde (Aβ), d’enchevêtrements neurofibrillaires (NFT) et de stress oxydatif dans le cerveau. Les facteurs de risque liés à l’apparition et au développement de la MA sont divers et comprennent des facteurs génétiques, des facteurs environnementaux et une activité métabolique altérée tels que l’obésité, le diabète de type 2 (DT2), l’athérosclérose et les maladies cardiovasculaires.
La maladie d’Alzheimer (MA), caractérisée par l’accumulation de plaques bêta-amyloïde (Aβ), d’enchevêtrements neurofibrillaires (NFT) et de stress oxydatif dans le cerveau. Les facteurs de risque liés à l’apparition et au développement de la MA sont divers et comprennent des facteurs génétiques, des facteurs environnementaux et une activité métabolique altérée tels que l’obésité, le diabète de type 2 (DT2), l’athérosclérose et les maladies cardiovasculaires.
L’irisine, une myokine produite par le tissu musculaire augmente le métabolisme énergétique, régule l’homéostasie du glucose et est directement lié à la conversion du tissu adipeux blanc en tissu adipeux brun. L’irisine améliore la fonction cérébrale en modulant la sécrétion de neurotransmetteurs et pourrait jouer un rôle bénéfique dans la MA. Elle est impliquée dans diverses voies métaboliques impliquées dans la genèse de la MA.
2. Maladie d’Alzheimer
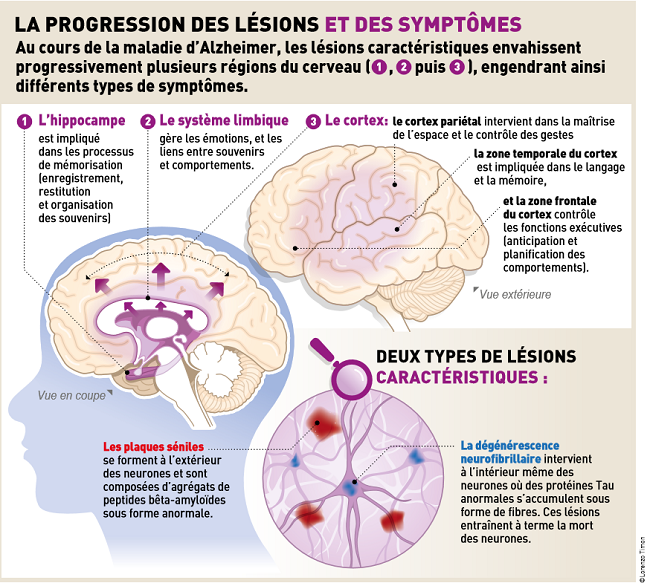
La MA est le type de démences le plus courant. Cette pathologies résulte des plaques Aβ qui se forment à l’extérieur des neurones et de l’accumulation de plaques amyloïdes intraneuronales. La diminution du processus de clairance de l’Aβ dans le SNC conduit au développement de la MA. La réduction du processus de clairance de l’Aβ déclenche l’accumulation excessive d’Aβ dans le cerveau et l’angiopathie amyloïde cérébrale.
La MA est caractérisée par des troubles cognitifs et des pertes de mémoire qui sont liés à une plasticité synaptique altérée. La neurogenèse hippocampique joue un rôle clé dans la plasticité synaptique et influence finalement les processus d’apprentissage et de mémoire dans le cerveau. Les patients atteints de MA présentent une neurogenèse hippocampique anormale. L’apparition et le développement de la MA sont associés à des facteurs génétiques, un dysfonctionnement mitochondrial, des dommages oxydatifs, des facteurs environnementaux et une altération du métabolisme énergétique.
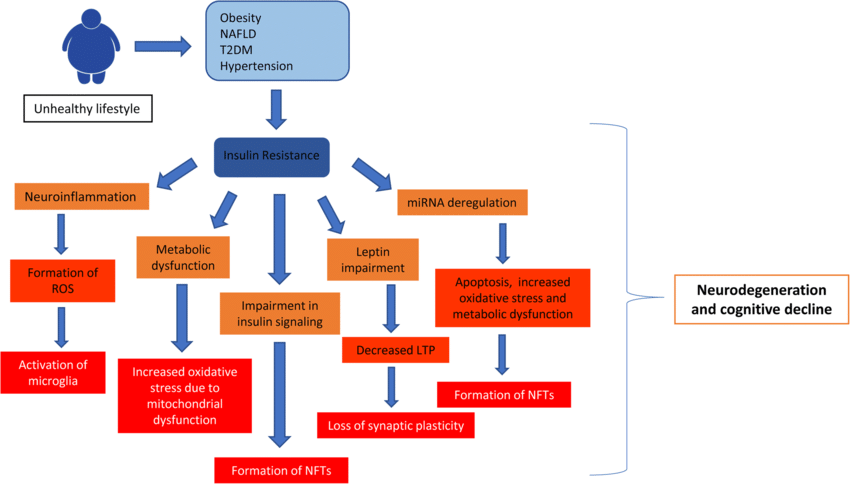
Cliniquement, les patients atteints de MA présentent généralement une ou plusieurs comorbidités telles que l’hypertension, l’obésité, la résistance à l’insuline, le diabète, l’athérosclérose et des déficiences métaboliques. La plupart des patients atteints de la forme sporadique de la MA sont liés à de nombreux mécanismes pathogènes, notamment l’atrophie cérébrale, l’inflammation, le stress oxydatif, une altération du métabolisme du glucose, la résistance à l’insuline et le DT2.
 Une étude in vivo a démontré qu’un régime riche en graisses augmente l’expression de la
Une étude in vivo a démontré qu’un régime riche en graisses augmente l’expression de la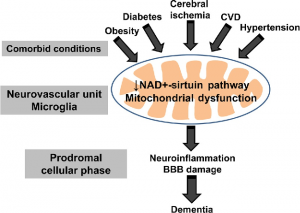 protéine précurseur Aβ (APP) et les niveaux d’enzymes de traitement de l’APP. De plus, d’autres études ont montré qu’un modèle d’obésité induite par un régime présentait un dysfonctionnement de la mémoire et une neuroinflammation. L’élévation de la réponse inflammatoire dans les vaisseaux sanguins déclenche la réduction de la plasticité synaptique et altère la neurogenèse. Des études cliniques ont démontré que l’obésité entraîne une diminution de la fonction cognitive, une atrophie de la substance blanche, une perturbation de la barrière hémato-encéphalique et augmente le risque de MA. Même si la prévalence de la MA augmente progressivement dans le monde, des solutions thérapeutiques et des méthodes de prévention efficaces font encore défaut.
protéine précurseur Aβ (APP) et les niveaux d’enzymes de traitement de l’APP. De plus, d’autres études ont montré qu’un modèle d’obésité induite par un régime présentait un dysfonctionnement de la mémoire et une neuroinflammation. L’élévation de la réponse inflammatoire dans les vaisseaux sanguins déclenche la réduction de la plasticité synaptique et altère la neurogenèse. Des études cliniques ont démontré que l’obésité entraîne une diminution de la fonction cognitive, une atrophie de la substance blanche, une perturbation de la barrière hémato-encéphalique et augmente le risque de MA. Même si la prévalence de la MA augmente progressivement dans le monde, des solutions thérapeutiques et des méthodes de prévention efficaces font encore défaut.
3. Qu’est-ce que l’irisine ?
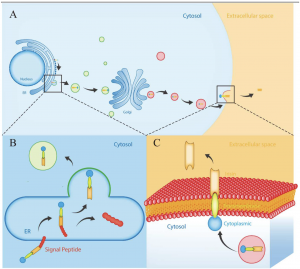
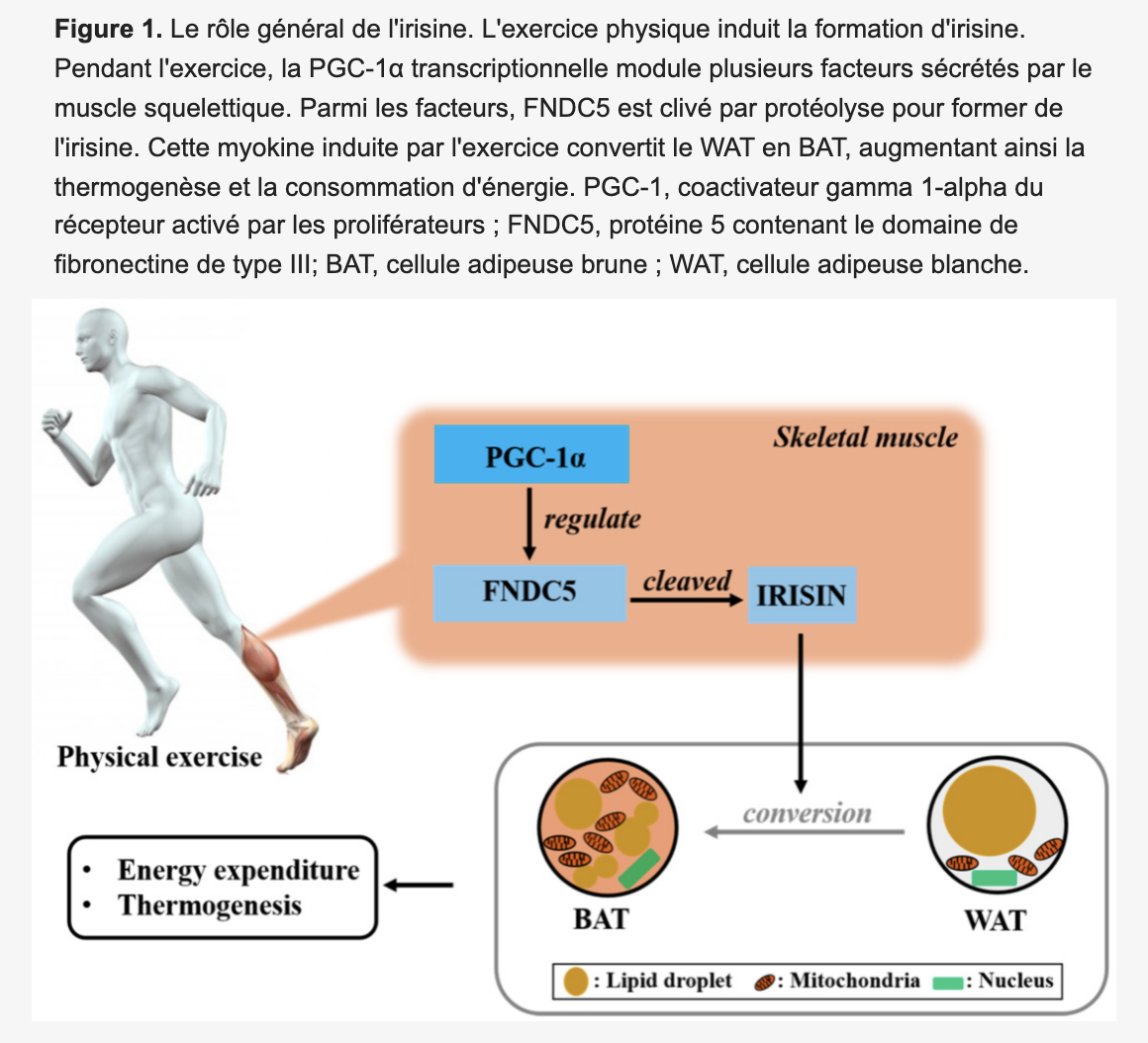
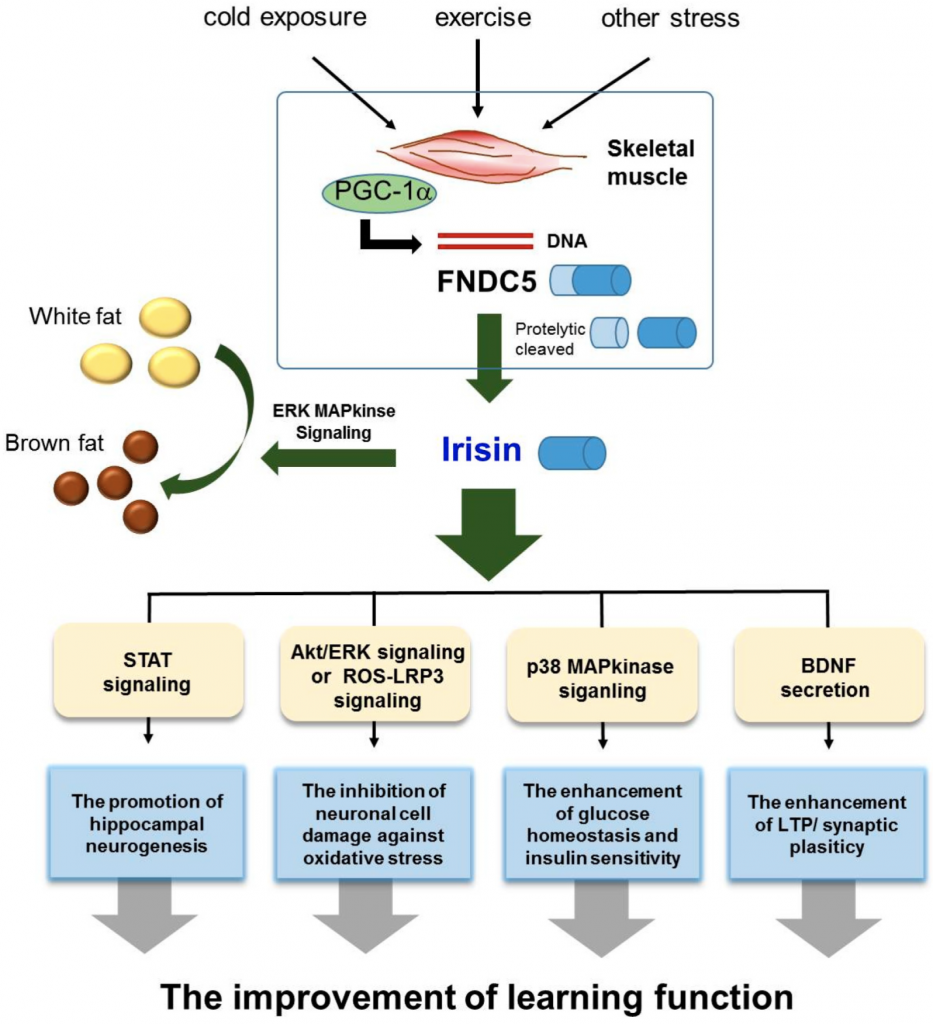
L’irisine en tant que protéine-hormone glycosylée à 112 acides aminés est formée par le clivage protéolytique de FNDC5. En bref, le polypeptide est clivé par protéolyse de la fraction C-terminale après que le peptide signal N-terminal ai été retiré, puis glycosylé et libéré sous la forme d’une hormone de 112 acides aminés. La formation de FNDC5 (la protéine 5 contenant le domaine de la fibronectine de type III , précurseur de l’ irisine) est favorisée par l’ exercice dans le muscle et pourrait être changée en irisine par la transcription co-activateur PPAR γ coactivateur-1 α (PGC1 α ). L’irisine est sécrétée par les muscles, circule dans les tissus adipeux et régule le métabolisme énergétique.
Lors d’une exposition au froid, l’activité musculaire induit la production d’irisine qui joue un rôle régulateur endocrinien du métabolisme de la graisse brune. Chez l’homme, l’expression de l’ARNm de FNDC5 induisant la, synthèse de l’irisine est environ 100 fois plus faible dans le tissu adipeux que dans le muscle squelettique. La sécrétion d’irisine par les adipocytes est également inférieure à celle du muscle squelettique. Le niveau d’irisine dans le tissu adipeux blanc humain n’est que de 5% du niveau trouvé dans le muscle squelettique. De plus, l’irisine, d’origine périphérique et neuronale, circule dans tout le corps. Les mammifères ont deux types de tissu adipeux blanc (WAT) et brun (BAT) . L’ irisine favorise le processus de brunissement du tissu adipeux blanc en tissu adipeux brun. L’accumulation excessive de tissu adipeux blanc conduit à l’obésité et entraîne un déséquilibre énergétique et une inflammation chronique. Le tissu adipeux brun est responsable de la thermogenèse énergétique en raison de la présence de nombreuses grandes mitochondries. L’irisine stimule le brunissement des graisses. De plus, il a été rapporté que la sécrétion d’irisine augmentait après l’exercice et influence la régulation de l’homéostasie du glucose et du métabolisme des lipides dans le muscle squelettique et le tissu adipeux.
L’irisine est connue pour jouer un rôle crucial dans le SNC
- Elle est présente dans le liquide céphalo-rachidien (LCR) et l’hypothalamus.
- L’irisine est connu pour être fortement exprimé dans la glie (par exemple, les astrocytes et la microglie) et les neurones dans diverses régions du cerveau.
- Elle est présente dans les cellules de Purkinje cérébelleuses et les terminaisons nerveuses intercellulaires.
- L’irisine contribue à la différenciation neuronale en modulant les réponses métaboliques dans le SNC.
- Elle exerce des effets de type antidépresseur.
- L’irisine dérivée des muscles squelettiques est liée aux processus liés à la récompense et à la motivation.
- Elle joue un rôle bénéfique dans la fonction cérébrale et dans les maladies neurodégénératives telles que la MA.
4. Les rôles thérapeutiques potentiels de l’irisine dans la maladie d’Alzheimer
4.1. L’irisine améliore l’apprentissage et la mémoire en régulant l’expression du facteur neurotrophique dérivé du cerveau (BDNF)
 Le facteur neurotrophique dérivé du cerveau (BDNF) en tant que neurotrophine largement distribuée dans le cerveau est connu pour jouer un rôle essentiel dans la fonction synaptique et la survie neuronale. En outre, le BDNF supprime la réponse cytotoxique des neurones et les déficits d’apprentissage liés à la toxicité de la plaque amyloïde Aβ dans la MA .
Le facteur neurotrophique dérivé du cerveau (BDNF) en tant que neurotrophine largement distribuée dans le cerveau est connu pour jouer un rôle essentiel dans la fonction synaptique et la survie neuronale. En outre, le BDNF supprime la réponse cytotoxique des neurones et les déficits d’apprentissage liés à la toxicité de la plaque amyloïde Aβ dans la MA .
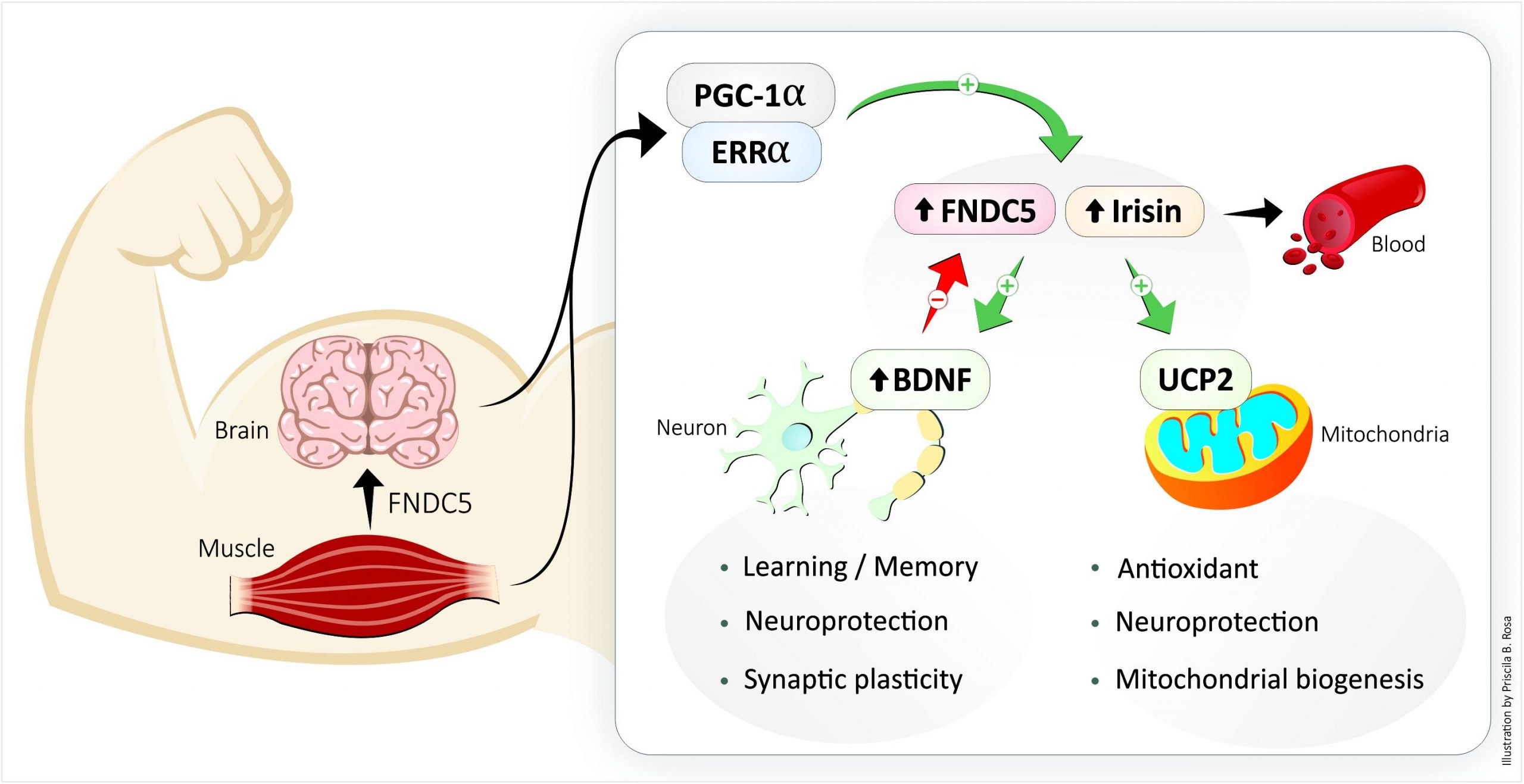
L’irisine est le médiateur en amont de la production de BDNF et déclenche l’expression de BDNF. L’augmentation induite par l’exercice de la libération de FNDC5/irisine à partir de la périphérie entraîne une augmentation de FNDC5/irisine dans les neurones ainsi qu’une augmentation de la production de BDNF dans le neurone.
Rôle du BDNF
- Le BDNF contrôle les voies de signalisation de la dopamine-3, influençant l’effet de la dopamine sur le cerveau et modulant la plasticité synaptique et la neurogenèse dans l’amygdale, le cortex préfrontal et l’hippocampe.
- Le BDNF augmente la force des connexions synaptiques. Le BDNF est nécessaire à la neurogenèse hippocampique et au circuit neuronal hippocampique.
- Le BDNF joue un rôle important dans la fonction d’apprentissage et de mémoire.
- Des niveaux réduits de neurotrophines telles que le BDNF ont été montrés dans diverses régions du cerveau dans la MA.
- Plusieurs études ont démontré que l’administration de BDNF chez les patients atteints de MA améliore la maladie.
- Des études récentes ont démontré que l’axe irisine-BDNF pouvait renforcer les fonctions d’apprentissage et de mémoire et améliorer les troubles de l’humeur et l’anxiété.
- Étant donné que l’expression du BDNF pourrait potentiellement améliorer le déclin cognitif dans la MA, la stimulation de l’axe irisine-BDNF dans le cerveau peut être une alternative thérapeutique prometteuse dans le traitement de la MA.
4.2. L’irisine favorise la neurogenèse et protège contre les dommages neuronaux causés par le stress oxydatif
- La neurogenèse qui se produit dans l’hippocampe est importante dans la plasticité synaptique structurelle et le maintien du réseau neuronal et contribue à la récupération du dysfonctionnement cognitif.
- La neurogenèse en tant que processus de remplacement du nouveau neurone dans la région de l’hippocampe est liée à l’apprentissage et est atténuée dans le cerveau des patients présentant la MA.
- L’irisine inhibe les dommages neuronaux causés par le stress oxydatif par l’activation de la signalisation Akt/ERK1/2.
- L’irisine protège les neurones en atténuant la sécrétion de cytokines pro-inflammatoires telles que le facteur de nécrose tumorale (TNF)-α via la signalisation Akt/ERK1/2.
- L’irisine protège les neurones en supprimant la signalisation inflammatoire ROS-NLRP3 dans les conditions ischémiques.
- Étant donné que l’amélioration de la neurogenèse pourrait potentiellement améliorer la plasticité synaptique altérée et le dysfonctionnement de la mémoire trouvés dans la MA, l’irisine peut être une cible thérapeutique potentielle pour la MA car elle favorise à la fois la neurogenèse et la survie des cellules neuronales ainsi que la synaptogenèse aussi appelé potentialisation à long terme (LTP), impliquée dans la mémoire à long terme.
4.3. L’irisine améliore la sensibilité à l’insuline et améliore l’homéostasie du glucose
L’altération du métabolisme cérébral du glucose et de la signalisation de l’insuline sont deux mécanismes pathologiques majeurs de la MA et sont fortement impliqués dans l’apprentissage et la perte de mémoire. L’altération de l’absorption du glucose dans le cerveau déclenche une atrophie cérébrale et un dysfonctionnement neuronal dans la MA. Une étude a rapporté que le déficit en transporteur de glucose (GLUT) dans les cellules endothéliales du cerveau aggrave la neuropathologie de la MA telle que le déclin cognitif.
L’irisine et l’homéostasie du glucose
- L’irisine agit comme un régulateur de l’utilisation du glucose et du brunissement du tissu adipeux blanc dans les modèles d’obésité et de DT2.
- Le taux d’irisine sérique et le polymorphismes nucléotidiques simples dans le FNDC5 sont associés au métabolisme du glucose et à la résistance à l’insuline.
- Les taux d’irisine circulante sont plus élevés chez les patients atteints du syndrome métabolique que chez les sujets normaux et une réduction des taux d’irisine circulante est associée à une résistance à l’insuline.
- L’irisine a des effets bénéfiques sur la sensibilité à l’insuline et le métabolisme du glucose à la fois dans le muscle squelettique et le tissu adipeux.
- Les taux sériques d’irisine est significativement plus bas chez les sujets diabétiques que chez les sujets normaux.
- L’irisine diminue l’expression de G6Pase et PEPCK, qui sont tous deux critiques pour la néoglucogenèse, dans le foie.
- L’irisine contrôle l’utilisation du glucose via la signalisation p38 MAPK .
- La surexpression de FNDC5/irisine améliore la résistance à l’insuline et réduit la glycémie chez les souris nourries avec un régime riche en graisses.
- L’expression de la membrane plasmique GLUT-4 est activée dans les muscles squelettiques des rats traités à l’irisine. L »irisine peut donc être un modulateur central du métabolisme du glucose et de l’activité de l’insuline dans le cerveau des patients présentante MA.
5. Conclusions
L’irisine est impliquée dans la modulation de plusieurs facteurs de risque de la MA, notamment la résistance à l’insuline, la neurogenèse altérée, le stress oxydatif et le déséquilibre des facteurs neurotrophiques. L’irisine peut donc jouer un rôle thérapeutique potentiel dans la MA.
- L’irisine stimule la production de BDNF, ce qui pourrait par la suite entraîner une amélioration cognitive et une réduction du dysfonctionnement synaptique dans la MA.
- L’irisine pourrait potentiellement améliorer la neurogenèse et protéger contre les dommages neuronaux dans la MA.
- L’irisine pourrait jouer un rôle dans la régulation de la résistance à l’insuline et de l’homéostasie du glucose dans la MA.
- Il est nécessaire de trouver un traitement approprié pour soulager la pathologie de la MA et l’irisine est prometteuse en tant qu’hormone thérapeutique. L’irisine peut être qualifiée d’« hormone d’exercice » puisque l’expression de l’irisine induite par l’exercice stimule dans l’hippocampe la production de BDNF et la transcription d’autres gènes neuroprotecteurs.
- Le traitement par l’irisine pourrait supprimer l’expression de cytokines pro-inflammatoires telles que le TNF-alpha et l’IL-6, réduire l’expression de la protéine chimiotactique des monocytes-1 dans les adipocytes, atténuer par la suite la migration des macrophages et induire la commutation phénotypique des macrophages de l’état M1 (pro-inflammatoire) à M2 (anti-inflammatoire).
- En cas d’ischémie cérébrale, les chercheurs ont observé que des niveaux accrus de ROS et de malondialdéhyde étaient réduits par le traitement à l’irisine dans les tissus cérébraux péri-infarctus.
- Au niveau mitochondrial, les protéines de découplage en tant que régulatrices de la biogenèse mitochondriale et de la neuroprotection et de la fonction synaptique dans le SNC ont été augmentées par l’administration de doses élevées d’irisine dans toutes les zones du cerveau.
- Compte tenu de ces applications cliniques de l’irisine, il est légitime de supposer que l’irisine peut contribuer à l’amélioration de la neuropathie en réduisant la neuroinflammation et en améliorant les fonctions synaptiques dans le cerveau en cas de MA. À la lumière des preuves présentées, nous proposons que les patients atteints de MA puissent être encadré afin de pouvoir bénéficier d’une quantité appropriée d’exercice pour promouvoir la neurogenèse, la survie neuronale et la plasticité synaptique. L’irisine pourrait être une cible future potentielle pour améliorer la pathologie de la MA et prévenir l’apparition de la MA.
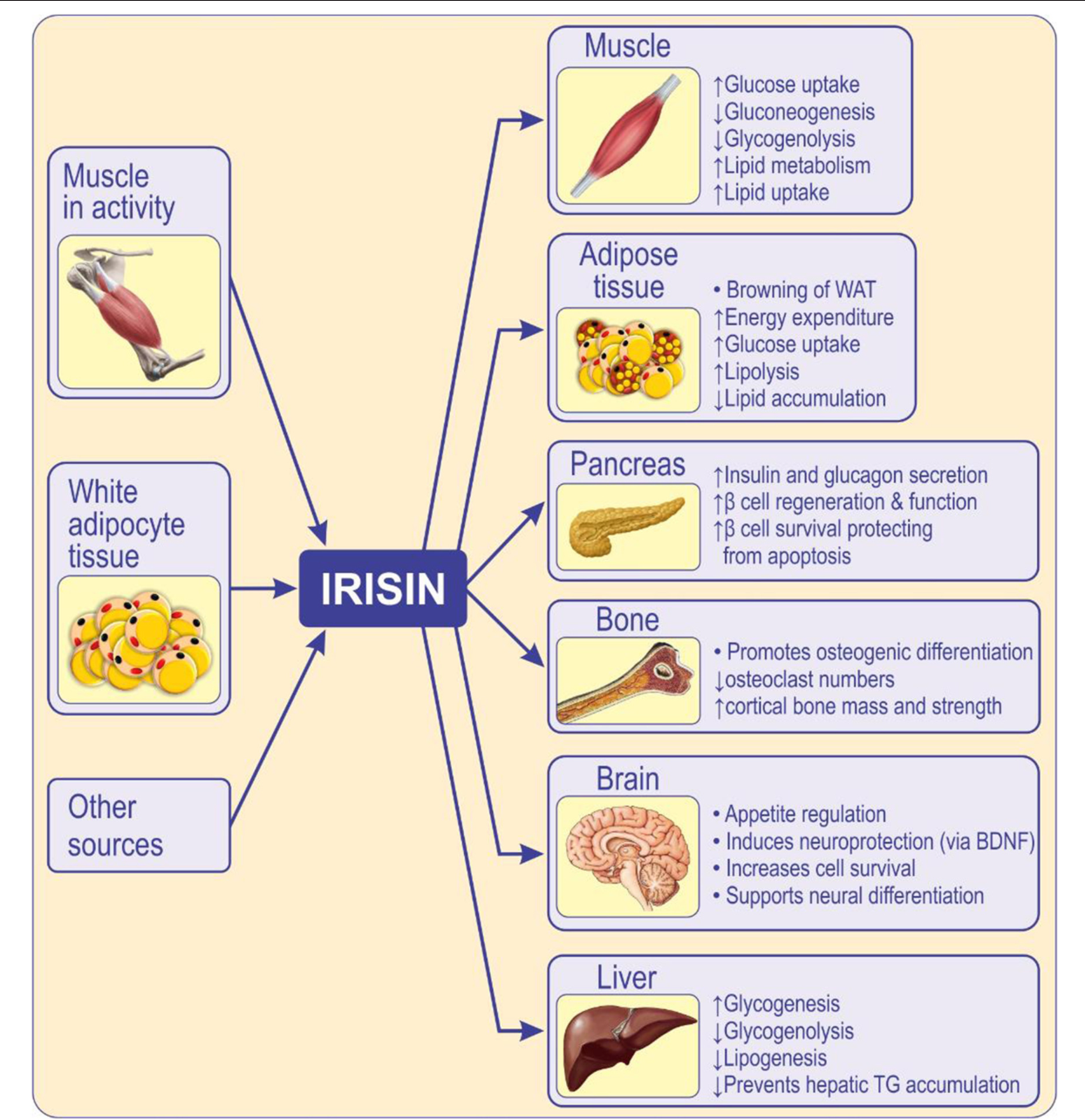
L’irisine circulante provient principalement du muscle squelettique pendant l’activité et du tissu adipeux. L’irisine agit localement, de manière autocrine/paracrine et lorsqu’elle est libérée dans la circulation agit de manière hormonale en médiant l’activité périphérique. L’irisine a des fonctions multispectrales sur divers tissus ou organes : inhibe la différenciation adipeuse tout en favorisant la différenciation ostéogénique, influence la fonction des muscles squelettiques, du pancréas, du foie, du cerveau et des os, améliore la sensibilité à l’insuline, le métabolisme, la cognition et l’ostéogenèse. L’irisine améliore la résistance à l’insuline et le diabète de type 2 en augmentant la sensibilité du récepteur de l’insuline dans le muscle squelettique et le cœur, en améliorant le métabolisme hépatique du glucose et des lipides et en favorisant les fonctions des cellules β pancréatiques, et le brunissement du tissu adipeux blanc (86). WAT, tissu adipeux blanc ; BDNF, facteur neurotrophique dérivé du cerveau.
Bibliographie
- The Role of Irisin in Alzheimer’s Disease. Oh YoenKim and Juhyun Song. J. Clin. Med. 2018, 7(11), 407; https://doi.org/10.3390/jcm7110407
- Insulin resistance: a connecting link betweenAlzheimer’s disease and metabolic disorder. Viplav Kshirsagar, Chetan Thingore & Archana Juvekar. Metabolic Brain Disease volume 36, pages 67–83 (2021).
- Insulin resistance: a connecting link between Alzheimer’s disease and metabolic disorder. January 2021. Viplav Kshirsagar, Chetan Thingore. Metabolic Brain Disease 36(1). DOI:10.1007/s11011-020-00622-2
- Maladie d’Alzheimer. Que se passe-t-il dans le cerveau ? Fojhdation Recherche Médicale. https://www.frm.org/recherches-maladies-neurologiques/maladie-d-alzheimer/alzheimer-que-se-passe-t-il-dans-le-cerveau
- Cleavage of FNDC5 and insights into its maturation process. Molecular and Cellular Endocrinolog. 23 April 2020
- Metabolic Syndrome and the Cellular Phase of Alzheimer’s Disease. Pugazhenthi S. Prog Mol BiolTransl Sci 2017;146:243-258. doi: 10.1016/bs.mbts.2016.12.016
- Molecular and Functional Interaction of the Myokine Irisin with Physical Exercise and Alzheimer’s Disease. Yunho Jin, Yonggeun Hong and All. Molecules 2018, 23(12), 3229; https://doi.org/10.3390/molecules23123229
- The Role of PGC-1α/UCP2 Signaling in the Beneficial Effects of Physical Exercise on the Brain. Viviane José De Oliveira Bristot, Ana Cristina De Bem Alves, Liziane Rosa Cardoso , Debora Da Luz Scheffer, Aderbal S Aguiar Jr. MINI REVUE article. De face. Neurosci., 29 mars 2019. https://doi.org/10.3389/fnins.2019.00292
- New insights into the cellular activities of Fndc5/Irisin and its signaling pathways. Farzaneh Rabiee, Liana Lachinani, Sarvenaz Ghaedi, Mohammad Hossein Nasr-Esfahani, Timothy L. Megraw, Kamran Ghaedi. Cell & Bioscience volume 10, Article number: 51. Publisched 30 March 2020
- Irisin: A Hope in Understanding and Managing Obesity and Metabolic Syndrome. Lidia Iuliana Arhire, Laura Mihalache and Mihai Covasa. REVIEW article. Front. Endocrinol., 02 August 2019. https://doi.org/10.3389/fendo.2019.00524